Oxidanty sa vo všeobecnosti vyrábajú kontrolovaným spôsobom, aby sa regulovali základné procesy v ľudskom tele, vrátane bunkového delenia, zápalu, imunitnej funkcie, autofágie a stresovej reakcie. K tomu však môže prispieť nekontrolovaná produkcia týchto oxidantov oxidačný stres, čo môže ovplyvniť bunkovú funkciu, čo vedie k rozvoju toxicity, chronických ochorení a rakoviny. Ochranné antioxidačné mechanizmy ľudského tela sú regulované sériou životne dôležitých dráh, ktoré riadia odpoveď bunky na oxidanty. Nukleárny faktor erytroidný 2-príbuzný faktor, inak známy ako Nrf2, je novým regulátorom bunkovej rezistencie voči oxidantom. Účelom nižšie uvedeného článku je diskutovať a demonštrovať vznikajúcu úlohu Nrf2 v mitochondriálnej funkcii.
Obsah
abstraktné
Transkripčný faktor NF-E2 faktor 45 súvisiaci s p2 (Nrf2; názov génu NFE2L2) umožňuje adaptáciu a prežitie v podmienkach stresu reguláciou génovej expresie rôznych sietí cytoprotektívnych proteínov, vrátane antioxidačných, protizápalových a detoxikačných enzýmov. ako proteíny, ktoré pomáhajú pri oprave alebo odstraňovaní poškodených makromolekúl. Nrf2 má kľúčovú úlohu pri udržiavaní bunkovej redoxnej homeostázy reguláciou biosyntézy, využitia a regenerácie glutatiónu, tioredoxínu a NADPH a riadením produkcie reaktívnych foriem kyslíka mitochondriami a NADPH oxidázou. V homeostatických podmienkach Nrf2 ovplyvňuje mitochondriálny membránový potenciál, oxidáciu mastných kyselín, dostupnosť substrátov (NADH a FADH2/sukcinát) pre dýchanie a syntézu ATP. V podmienkach stresu alebo stimulácie rastovým faktorom aktivácia Nrf2 pôsobí proti zvýšenej produkcii reaktívnych foriem kyslíka v mitochondriách prostredníctvom transkripčnej upregulácie uncoupling proteínu 3 a ovplyvňuje mitochondriálnu biogenézu udržiavaním hladín jadrového respiračného faktora 1 a receptora aktivovaného peroxizómovým proliferátorom? koaktivátorom 1p, ako aj podporou biosyntézy purínových nukleotidov. Farmakologické aktivátory Nrf2, ako je prirodzene sa vyskytujúci izotiokyanát sulforafan, inhibujú oxidantom sprostredkované otvorenie pórov prechodu mitochondriálnej permeability a opuch mitochondrií. Je zvláštne, že sa zistilo, že syntetická 1,4-difenyl-1,2,3-triazolová zlúčenina, pôvodne navrhnutá ako aktivátor Nrf2, podporuje mitofágiu, čím prispieva k celkovej mitochondriálnej homeostáze. Nrf2 je teda popredným hráčom pri podpore štrukturálnej a funkčnej integrity mitochondrií a táto úloha je obzvlášť kľúčová v podmienkach stresu.
Kľúčové slová: Bioenergetika, Cytoprotekcia, Keap1, Mitochondrie, Nrf2, Voľné radikály
prednosti
- Nrf2 má kľúčovú úlohu pri udržiavaní bunkovej redoxnej homeostázy.
- Nrf2 ovplyvňuje mitochondriálny membránový potenciál a syntézu ATP.
- Nrf2 ovplyvňuje mitochondriálnu oxidáciu mastných kyselín.
- Nrf2 podporuje štrukturálnu a funkčnú integritu mitochondrií.
- Aktivátory Nrf2 majú priaznivé účinky, keď je ohrozená mitochondriálna funkcia.
úvod
Transkripčný faktor NF-E2 faktor 45 súvisiaci s p2 (Nrf2; názov génu NFE2L2) reguluje expresiu sietí génov kódujúcich proteíny s rôznymi cytoprotektívnymi aktivitami. Samotný Nrf2 je kontrolovaný predovšetkým na úrovni proteínovej stability. Za bazálnych podmienok je Nrf2 proteín s krátkou životnosťou, ktorý podlieha kontinuálnej ubikvitinácii a proteazomálnej degradácii. Existujú tri známe systémy ubikvitín ligázy, ktoré prispievajú k degradácii Nrf2. Historicky prvým negatívnym regulátorom Nrf2, ktorý bol objavený, bol Kelch-like ECH-asociovaný proteín 1 (Keap1) [1], substrátový adaptorový proteín pre ubikvitín ligázu Cullin 3 (Cul3)/Rbx1 [2], [3], [ 4]. Keap1 využíva vysoko účinný cyklický mechanizmus na zacielenie Nrf2 na ubikvitináciu a proteazomálnu degradáciu, počas ktorej sa Keap1 kontinuálne regeneruje, čo umožňuje priebeh cyklu (obr. 1A) [5]. Nrf2 je tiež vystavený degradácii sprostredkovanej ubikvitín ligázou na báze glykogénsyntázy (GSK)3/a-TrCP-dependentnej Cul1 [6], [7]. Najnovšie sa uvádza, že v podmienkach stresu endoplazmatického retikula je Nrf2 ubikvitinovaný a degradovaný v procese sprostredkovanom E3 ubikvitín ligázou Hrd1 [8].
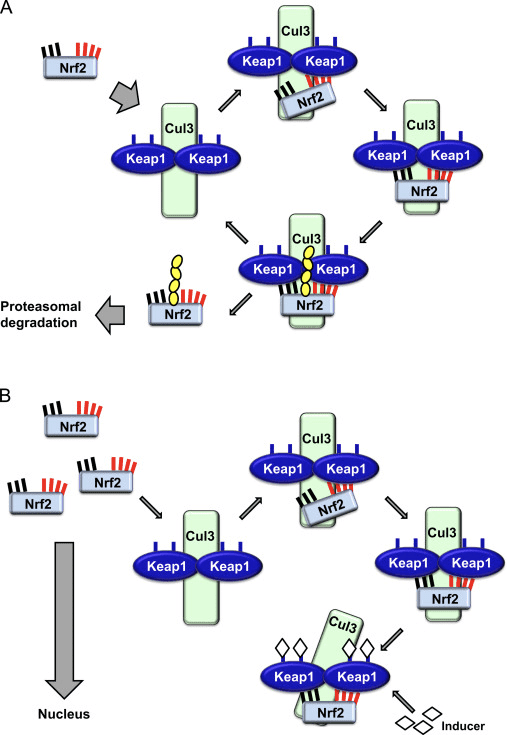
Okrem toho, že Keap1 slúži ako adaptérový proteín substrátu ubikvitín ligázy, je tiež senzorom pre širokú škálu nízkomolekulových aktivátorov Nrf2 (nazývaných induktory) [9]. Induktory blokujú cyklus degradácie Nrf1 sprostredkovanej Keap2 chemickou modifikáciou špecifických cysteínových zvyškov v Keap1 [10], [11] alebo priamym narušením väzbového rozhrania Keap1:Nrf2 [12], [13]. V dôsledku toho nie je Nrf2 degradovaný a transkripčný faktor sa hromadí a translokuje do jadra (obr. 1B), kde tvorí heterodimér s malým proteínom Maf; viaže sa na prvky antioxidačnej odozvy, upstream regulačné oblasti svojich cieľových génov; a iniciuje transkripciu [14], [15], [16]. Batéria cieľov Nrf2 obsahuje proteíny s rôznymi cytoprotektívnymi funkciami, vrátane enzýmov metabolizmu xenobiotík, proteínov s antioxidačnými a protizápalovými funkciami a proteazomálnych podjednotiek, ako aj proteínov, ktoré regulujú bunkovú redoxnú homeostázu a podieľajú sa na intermediárnom metabolizme.
Nrf2: Hlavný regulátor bunkovej redoxnej homeostázy
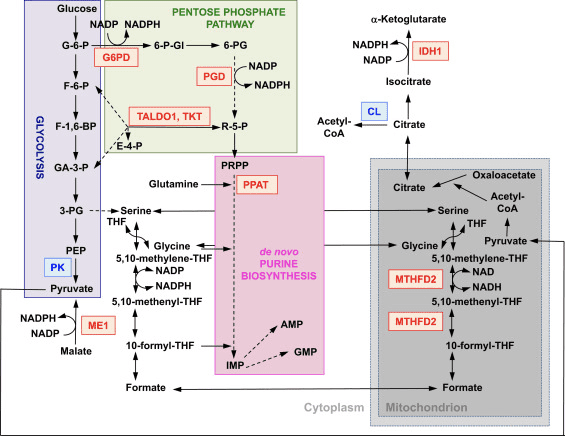
Funkcia Nrf2 ako hlavného regulátora bunkovej redoxnej homeostázy je široko uznávaná. Génová expresia katalytickej aj regulačnej podjednotky β-glutamylcysteín ligázy, enzýmu katalyzujúceho rýchlosť obmedzujúci krok v biosyntéze redukovaného glutatiónu (GSH), je priamo regulovaná Nrf2 [17]. Podjednotka xCT systému xc-, ktorá importuje cystín do buniek, je tiež priamym transkripčným cieľom Nrf2 [18]. V bunke cystín prechádza konverziou na cysteín, prekurzor pre biosyntézu GSH. Okrem svojej úlohy v biosyntéze GSH, Nrf2 poskytuje prostriedky na udržanie glutatiónu v redukovanom stave koordinovanou transkripčnou reguláciou glutatiónreduktázy 1 [19], [20], ktorá redukuje oxidovaný glutatión na GSH pomocou redukčných ekvivalentov z NADPH. . Požadovaný NADPH zabezpečujú štyri hlavné enzýmy generujúce NADPH, jablčný enzým 1 (ME1), izocitrátdehydrogenáza 1 (IDH1), glukóza-6-fosfátdehydrogenáza (G6PD) a 6-fosfoglukonátdehydrogenáza (PGD), z ktorých všetky sú transkripčne regulované čiastočne Nrf2 (obr. 2) [21], [22], [23], [24]. Je zvláštne, že Nrf2 tiež reguluje indukovateľnú génovú expresiu cytosolických, mikrozomálnych a mitochondriálnych foriem aldehyddehydrogenázy [25], ktoré využívajú NAD(P)+ ako kofaktor, čím vzniká NAD(P)H. Hladiny NADPH a pomer NADPH/NADP+ sú skutočne nižšie v embryonálnych fibroblastoch izolovaných z myší s knockoutom Nrf2 (Nrf2-KO) v porovnaní s bunkami z ich náprotivkov divokého typu (WT) a hladiny NADPH sa znižujú po knockdowne Nrf2 v r. rakovinové bunkové línie s konštitutívne aktívnym Nrf2 [26]. Ako sa očakávalo, hladiny GSH sú nižšie v bunkách, v ktorých bol Nrf2 narušený; naopak, aktivácia Nrf2 genetickými alebo farmakologickými prostriedkami vedie k upregulácii GSH [27], [28], [29]. Dôležité je, že Nrf2 tiež reguluje génovú expresiu tioredoxínu [30], [31], [32], tioredoxín reduktázy 1 [28], [29], [32], [33] a sulfiredoxínu [34], ktoré sú esenciálne na redukciu oxidovaných proteínových tiolov.
Vzhľadom na kľúčovú úlohu Nrf2 ako hlavného regulátora bunkovej redoxnej homeostázy nie je prekvapujúce, že v porovnaní s bunkami WT sú hladiny reaktívnych foriem kyslíka (ROS) vyššie v bunkách, v ktorých bol Nrf2 narušený (Nrf2-KO) [35]. Tento rozdiel je obzvlášť markantný pri napadnutí látkami, ktoré spôsobujú oxidačný stres. Navyše bunky s deficitom Nrf2 sú oveľa citlivejšie na toxicitu oxidantov rôznych typov a nemôžu byť chránené induktormi Nrf2, ktoré za rovnakých podmienok poskytujú účinnú a dlhotrvajúcu ochranu bunkám WT [29], [36] [37]. Okrem celkovej bunkovej redoxnej homeostázy je Nrf2 tiež rozhodujúci pre udržanie mitochondriálnej redoxnej homeostázy. V porovnaní s WT je teda celkový mitochondriálny súbor NADH významne zvýšený v Keap1-KO a dramaticky znížený v bunkách Nrf2-KO [35].
Pomocou zobrazenia živých buniek sme nedávno monitorovali rýchlosti produkcie ROS v primárnych glioneuronálnych kokultúrach a rezoch mozgového tkaniva izolovaných z myší WT, Nrf2-KO alebo Keap1-knockdown (Keap1-KD) [38]. Ako sa očakávalo, rýchlosť produkcie ROS bola rýchlejšia v bunkách a tkanivách Nrf2-KO v porovnaní s ich náprotivkami WT. Urobili sme však neočakávané pozorovanie, že v porovnaní s WT majú bunky Keap1-KD tiež vyššiu mieru produkcie ROS, hoci veľkosť rozdielu medzi genotypmi WT a Keap1-KD bola menšia ako medzi WT a Nrf2-KO. . Potom sme analyzovali hladiny mRNA NOX2 a NOX4, katalytických podjednotiek dvoch izoforiem NADPH oxidázy (NOX), ktoré sa podieľajú na patológii mozgu, a zistili sme, že NOX2 sa dramaticky zvyšuje v podmienkach nedostatku Nrf2, zatiaľ čo NOX4 je upregulovaný, keď Nrf2 sa konštitutívne aktivuje, aj keď v menšej miere. Kvantitatívne je veľkosť upregulácie v bunkách a tkanivách z mutantných myší paralelná so zodpovedajúcim zvýšením produkcie ROS [38]. Je zaujímavé, že Nrf2 nielen reguluje NADPH oxidázu, ale aj ROS produkovaný NADPH oxidázou môže aktivovať Nrf2, ako je ukázané v pľúcnych epiteliálnych bunkách a kardiomyocytoch [39], [40]. Okrem toho veľmi nedávna štúdia preukázala, že aktivácia Nrf2 závislá od NADPH oxidázy predstavuje dôležitý endogénny mechanizmus ochrany pred mitochondriálnym poškodením a bunkovou smrťou v srdci počas chronického tlakového preťaženia [41].
Okrem katalytickej aktivity NADPH oxidázy je ďalším hlavným intracelulárnym zdrojom ROS mitochondriálne dýchanie. Použitím mitochondriálnej špecifickej sondy MitoSOX sme skúmali príspevok ROS mitochondriálneho pôvodu k celkovej produkcii ROS v primárnych glioneuronálnych izolovaných kokultúrach z myší WT, Nrf2-KO alebo Keap1-KD [38]. Ako sa očakávalo, bunky Nrf2-KO mali vyššiu mieru mitochondriálnej produkcie ROS ako WT. V súlade so zisteniami o celkovej produkcii ROS boli miery produkcie mitochondriálnych ROS v Keap1-KD tiež vyššie v porovnaní s bunkami WT. Dôležité je, že blokovanie komplexu I s rotenónom spôsobilo dramatický nárast mitochondriálnej produkcie ROS v bunkách WT aj Keap1-KD, ale nemalo žiadny účinok v bunkách Nrf2-KO. Na rozdiel od očakávaného zvýšenia produkcie mitochondriálnych ROS v bunkách WT po pridaní pyruvátu (na zvýšenie dostupnosti NADH, zvýšenie potenciálu mitochondriálnej membrány a normalizáciu dýchania) sa produkcia ROS v bunkách Nrf2-KO znížila. Spoločne tieto zistenia silne naznačujú, že v neprítomnosti Nrf2: (i) je narušená aktivita komplexu I, (ii) narušená aktivita komplexu I je spôsobená obmedzením substrátov a (iii) narušená aktivita komplexu I je jedným z hlavných dôvodov zvýšenej mitochondriálnej produkcie ROS, pravdepodobne v dôsledku reverzného toku elektrónov z komplexu II.
Nrf2 ovplyvňuje mitochondriálny membránový potenciál a dýchanie
Mitochondriálny membránový potenciál (??m) je univerzálnym indikátorom mitochondriálneho zdravia a metabolického stavu bunky. V zdravej bunke je µm udržiavaný mitochondriálnym dýchacím reťazcom. Je zaujímavé, že stabilné izotopové značenie aminokyselinami v proteomickej štúdii založenej na kultúre v netumorogénnej bunkovej línii ľudského prsného epitelu MCF10A s negatívnym estrogénovým receptorom ukázalo, že zložka mitochondriálneho elektrónového transportného reťazca NDUFA4 je upregulovaná farmakologickou aktiváciou (sulforafanom) Nrf2, zatiaľ čo genetická upregulácia Nrf2 (knockdown Keap1) vedie k downregulácii podjednotiek cytochróm c oxidázy COX2 a COX4I1 [42]. Štúdia pečeňového proteómu pomocou dvojrozmernej gélovej elektroforézy a hmotnostnej spektrometrie s laserovou desorpciou/ionizáciou za pomoci matrice zistila, že Nrf2 reguluje expresiu podjednotky ATP syntázy ? [43]. Okrem toho sa uvádza, že mitochondriálny proteín DJ-1, ktorý hrá úlohu pri udržiavaní aktivity komplexu I [44], stabilizuje Nrf2 [45], [46], hoci neuroprotektívne účinky farmakologickej alebo genetickej aktivácie z Nrf2 sú nezávislé od DJ-1 [47]. Dôsledky týchto pozorovaní na mitochondriálnu funkciu však neboli skúmané.
V súlade so zhoršenou aktivitou komplexu I v podmienkach deficitu Nrf2 je bazálny ??m nižší v Nrf2-KO myších embryonálnych fibroblastoch (MEF) a kultivovaných primárnych glioneuronálnych bunkách v porovnaní s ich WT náprotivkami (obr. 3, vložka) [35]. Na rozdiel od toho, bazálny ??m je vyšší, keď je Nrf2 geneticky konštitutívne upregulovaný (knockdown alebo knockout Keap1). Tieto rozdiely v µm medzi genotypmi naznačujú, že dýchanie je ovplyvnené aktivitou Nrf2. Vyhodnotenie spotreby kyslíka v bazálnom stave skutočne odhalilo, že v porovnaní s WT je spotreba kyslíka nižšia v Nrf2-KO a Keap1-KO MEF o ~50 a ~35%.
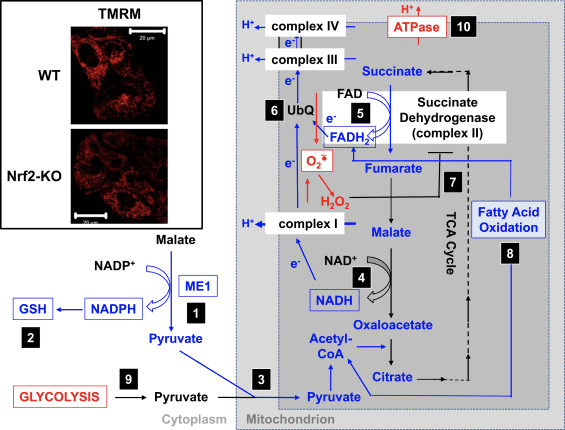
Tieto rozdiely v µm a dýchaní medzi genotypmi sa odrážajú v miere využitia substrátov na mitochondriálne dýchanie. Aplikácia substrátov pre cyklus trikarboxylových kyselín (TCA) (jablčnan/pyruvát, ktoré následne zvyšujú produkciu komplexu I, substrát NADH) alebo metylsukcinátu, substrátu pre komplex II, spôsobuje postupné zvyšovanie ??m v oboch WT a Keap1-KD neuróny, ale rýchlosť nárastu je vyššia v Keap1-KD bunkách. Ešte dôležitejšie je, že tvary odozvy na tieto substráty cyklu TCA sa medzi týmito dvoma genotypmi líšia, pričom rýchly nárast µm v bunkách Keap1-KD po pridaní substrátu je nasledovaný skôr rýchlym poklesom než plató, čo naznačuje nezvyčajne rýchla spotreba substrátu. Tieto zistenia sú v úzkej zhode s oveľa nižšími (o 50–70 %) hladinami malátu, pyruvátu a sukcinátu, ktoré boli pozorované po 1-hodinovom pulze [U-13C6]glukózy v Keap1-KO v porovnaní s WT MEF bunky [24]. V neurónoch Nrf2-KO je iba pyruvát schopný zvýšiť ??m, zatiaľ čo malát a metylsukcinát spôsobujú miernu depolarizáciu. Účinok Nrf2 na produkciu mitochondriálneho substrátu sa zdá byť hlavným mechanizmom, ktorým Nrf2 ovplyvňuje mitochondriálnu funkciu. Mitochondriálny redox index NADH (rovnováha medzi spotrebou NADH komplexom I a produkciou NADPH v cykle TCA) je výrazne nižší v bunkách Nrf2-KO v porovnaní s ich náprotivkami WT a navyše rýchlosti regenerácie poolov NADH a FADH2 po inhibícii komplexu IV (pomocou NaCN) sú v mutantných bunkách pomalšie.
V mitochondriách izolovaných z myšieho mozgu a pečene suplementácia substrátov pre komplex I alebo pre komplex II zvyšuje rýchlosť spotreby kyslíka výraznejšie, keď je aktivovaný Nrf2 a menej efektívne, keď je Nrf2 narušený [35]. Malát teda indukuje vyššiu mieru spotreby kyslíka v Keap1-KD v porovnaní s WT, ale jeho účinok je slabší v mitochondriách Nrf2-KO. Podobne v prítomnosti rotenónu (keď je komplex I inhibovaný) sukcinát aktivuje spotrebu kyslíka vo väčšej miere v Keap1-KD v porovnaní s WT, zatiaľ čo odpoveď v mitochondriách Nrf2-KO je znížená. Okrem toho sú primárne neurónové kultúry a myši Nrf2-KO citlivejšie na toxicitu inhibítorov komplexu II 3-nitropropiónovej kyseliny a malonátu, zatiaľ čo intrastriatálna transplantácia astrocytov s nadmernou expresiou Nrf2 je ochranná [48], [49]. Podobne aj myši Nrf2-KO sú citlivejšie na, zatiaľ čo genetická alebo farmakologická aktivácia Nrf2 má ochranné účinky proti neurotoxicite spôsobenej inhibítorom komplexu I 1-metyl-4-fenylpyridínium ión v 1-metyl-4-fenyl-1,2,3,6, 49-tetrahydropyridínový zvierací model Parkinsonovej choroby [50], [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [XNUMX].
Pomer kontroly dýchania (RCR), pomer stavu 3 (stimulované ADP) k dýchaniu v stave 4 (bez prítomnosti ADP), je znížený v neprítomnosti Nrf2, ale RCR je podobný medzi Keap1-KD a mitochondriami WT [35 ]. Keďže RCR je indikáciou stupňa spojenia aktivity mitochondriálneho dýchacieho reťazca s oxidačnou fosforyláciou, toto zistenie naznačuje, že vyššia rýchlosť dýchania v mitochondriách Keap1-KD nie je spôsobená odpojením oxidatívnej fosforylácie. Ďalej to naznačuje, že oxidačná fosforylácia je účinnejšia, keď je aktivovaný Nrf2. Vyššia rýchlosť dýchania v mitochondriách Keap1-KD je v súlade s vyššími hladinami mitochondriálnej produkcie ROS [38], pretože vyššie rýchlosti dýchania môžu viesť k zvýšenému úniku elektrónov. Avšak v podmienkach oxidačného stresu je zvýšená produkcia ROS neutralizovaná Nrf2-dependentnou transkripčnou upreguláciou uncoupling proteínu 3 (UCP3), ktorá zvyšuje protónovú vodivosť mitochondriálnej vnútornej membrány a následne znižuje produkciu superoxidu [62]. Veľmi nedávno sa ukázalo, že produkt peroxidácie lipidov 4-hydroxy-2-nonenal sprostredkuje Nrf2-dependentnú upreguláciu UCP3 v kardiomyocytoch; to môže byť obzvlášť dôležité pre ochranu v podmienkach oxidačného stresu, ako sú tie počas ischemickej reperfúzie [63].
Nrf2 ovplyvňuje účinnosť oxidačnej fosforylácie a syntézu ATP
V súlade s účinkom Nrf2 na dýchanie v mitochondriách mozgu a pečene vedie nedostatok Nrf2 k zníženiu účinnosti oxidačnej fosforylácie (ako sa odhaduje pomerom ADP ku kyslíku, ktorý sa spotrebuje na syntézu ATP), zatiaľ čo aktivácia Nrf2 (Keap1 -KD) má opačný účinok [35]. V porovnaní s WT sú hladiny ATP významne vyššie v bunkách s konštitutívnou upreguláciou Nrf2 a nižšie, keď je Nrf2 zrazený [64] alebo narušený [35]. Okrem toho použitie inhibítorov oxidatívnej fosforylácie (oligomycín) alebo glykolýzy (kyselina jódoctová) odhalilo, že Nrf2 mení spôsob, akým bunky produkujú ATP. V neurónoch WT teda oligomycín spôsobuje úplný pokles ATP a kyselina jódoctová už nemá žiadny ďalší účinok. Je pozoruhodné, že v bunkách Nrf2-KO oligomycín zvyšuje hladiny ATP, ktoré sa potom pomaly, ale úplne vyčerpávajú kyselinou jódoctovou, čo naznačuje, že v neprítomnosti Nrf2 je hlavným zdrojom produkcie ATP glykolýza a nie oxidačná fosforylácia. Je zaujímavé, že napriek zvýšenej účinnosti oxidačnej fosforylácie v bunkách Keap1-KD má pridanie oligomycínu za následok ~80% zníženie hladín ATP a kyselina jódoctová spôsobuje ďalší ~20% pokles. Deficit Nrf2 alebo jeho konštitutívna aktivácia teda znižuje príspevok oxidatívnej fosforylácie a zvyšuje príspevok glykolýzy k syntéze ATP. Tento účinok je obzvlášť výrazný, keď chýba Nrf2 a je v súlade so závislosťou ??m od prítomnosti glukózy v médiu [35] a zvýšených hladín glykolytických medziproduktov (G-6-P, F-6-P , dihydroxyacetón fosfát, pyruvát a laktát) po knockdown Nrf2 [24].
Zvýšenie hladín ATP po inhibícii F1F0-ATPázy oligomycínom naznačuje, že v neprítomnosti Nrf2 funguje F1F0-ATPáza ako ATPáza a nie ako ATP syntáza, tj funguje opačne. Takéto zvrátenie aktivity s najväčšou pravdepodobnosťou odráža potrebu pumpovať protóny cez vnútornú mitochondriálnu membránu v snahe udržať µm, čo je rozhodujúce pre funkčnú integritu tejto organely. O zvrátení funkcie F1F0-ATPázy svedčí aj pozorovaná mitochondriálna depolarizácia po podaní oligomycínu bunkám Nrf2-KO, čo je v ostrom kontraste s hyperpolarizáciou vyskytujúcou sa u ich náprotivkov s deficitom WT alebo Keap1 [35]. Celkovo sa zdá, že za podmienok nedostatku Nrf2 sa ATP produkuje primárne v glykolýze a tento ATP je potom čiastočne využívaný F1F0-ATPázou na udržanie ?m.
Nrf2 zvyšuje mitochondriálnu oxidáciu mastných kyselín
Účinok nedostatku Nrf2 na ??m je obzvlášť výrazný, keď sú bunky inkubované v médiu bez glukózy, a ??m je v Nrf50-KO ~2 % nižší v porovnaní s bunkami WT [35]. V podmienkach nedostatku glukózy je oxidácia mitochondriálnych mastných kyselín (FAO) hlavným poskytovateľom substrátov pre dýchanie a oxidačnú fosforyláciu, čo naznačuje, že Nrf2 môže ovplyvniť FAO. V skutočnosti je účinnosť FAO pre nasýtenú mastnú kyselinu palmitovú s dlhým reťazcom (C16:0) a kyselinu hexánovú s krátkym reťazcom (C6:0) vyššia v Keap1-KO MEF a izolovaných srdcových a pečeňových mitochondriách ako v ich náprotivky WT, zatiaľ čo v bunkách Nrf2-KO a mitochondriách je nižšia [65]. Tieto účinky sú tiež vysoko relevantné pre ľudí: skutočne sa uvádza, že metabolické zmeny naznačujúce lepšiu integráciu FAO s aktivitou cyklu TCA sa vyskytujú v intervenčných štúdiách u ľudí s diétami bohatými na glukorafanín, prekurzor klasického aktivátora Nrf2 sulforafanu [ 66].
Počas prvého kroku mitochondriálnej FAO odchádza pro-R vodík z a-uhlíka ako hydrid, ktorý redukuje FAD kofaktor na FADH2, ktorý následne prenáša elektróny na ubichinón (UbQ) v dýchacom reťazci, čo v konečnom dôsledku prispieva k produkcii ATP. . Zatiaľ čo stimulácia FAO palmitoylkarnitínom v neprítomnosti glukózy spôsobuje očakávané zvýšenie hladín ATP v bunkách WT a Keap1-KO, pričom nárast ATP je rýchlejší v bunkách Keap1-KO, identická liečba neprodukuje žiadne zmeny ATP v Nrf2-KO MEF [65]. Tento experiment ukazuje, že v neprítomnosti Nrf2 je FAO potlačená a okrem toho implikuje supresiu FAO ako jeden z dôvodov nižších hladín ATP v podmienkach nedostatku Nrf2 [35], [64].
Je pozoruhodné, že ľudské 293 T bunky, v ktorých bol Nrf2 umlčaný, majú nižšiu expresiu CPT1 a CPT2[67], dvoch izoforiem karnitín palmitoyltransferázy (CPT), enzýmu obmedzujúceho rýchlosť v mitochondriálnej FAO. V zhode sú hladiny mRNA Cpt1 nižšie v pečeni Nrf2-KO v porovnaní s myšami WT [68]. CPT katalyzuje prenos acylovej skupiny mastného acyl-CoA s dlhým reťazcom z koenzýmu A na l-karnitín a umožňuje tak import acylkarnitínu z cytoplazmy do mitochondrií. Hoci to doteraz nebolo preskúmané, je možné, že okrem transkripčných účinkov na expresiu CPT1 môže Nrf2 ovplyvňovať aj funkciu tohto enzýmu riadením hladín jeho hlavného alosterického inhibítora, malonyl-CoA. Je to preto, že mechanizmom, ktorý je v súčasnosti nejasný, Nrf2 negatívne reguluje expresiu stearoyl CoA desaturázy (SCD) [69] a citrát lyázy (CL) [69], [70]. Je zvláštne, že knockout alebo inhibícia SCD vedie k zvýšenej fosforylácii a aktivácii AMP-aktivovanej proteínkinázy (AMPK) [71], [72], [73] a možno špekulovať, že v neprítomnosti Nrf2 budú hladiny SCD sa zvýši, čím sa zníži aktivita AMPK. To by mohlo byť ďalej spojené so zníženými hladinami proteínov AMPK, ktoré boli pozorované v pečeni myší Nrf2-KO [68], čo je zistenie, ktoré je v úzkej zhode so zvýšenými hladinami AMPK, ktoré boli hlásené v pečeni Keap1-KD. myši [74]. Jedným z dôsledkov zníženej aktivity AMPK je zmiernenie jej inhibičnej fosforylácie (na Ser79) acetyl-CoA karboxylázy (ACC) [75], ktorá by mohla byť ďalej transkripčne upregulovaná v neprítomnosti Nrf2, pretože je downregulovaná aktiváciou Nrf2 [70 ]. Vysoká aktivita ACC v kombinácii s upregulovanou expresiou CL, ktorá zvýši produkciu acetyl-CoA, substrátu pre ACC, môže v konečnom dôsledku zvýšiť hladiny produktu ACC, malonyl-CoA. Vysoké hladiny malonyl-CoA budú inhibovať CPT, čím sa zníži transport mastných kyselín do mitochondrií. Nakoniec Nrf2 pozitívne reguluje expresiu CD36 [76], translokázy, ktorá importuje mastné kyseliny cez plazmatické a mitochondriálne membrány. Jedným mechanizmom, ktorým môže Nrf2 ovplyvniť účinnosť mitochondriálnej FAO, je teda regulácia importu mastných kyselín s dlhým reťazcom do mitochondrií.
Okrem priamej transkripčnej regulácie môže Nrf2 tiež meniť účinnosť mitochondriálnej FAO svojimi účinkami na bunkový redoxný metabolizmus. To môže byť obzvlášť dôležité, keď je aktivita Nrf2 nízka alebo chýba, podmienky, ktoré posúvajú bunkový redoxný stav smerom k oxidovanému stavu. V skutočnosti bolo niekoľko enzýmov FAO identifikovaných ako citlivých na redoxné zmeny. Jedným z takýchto enzýmov je acyl-CoA dehydrogenáza s veľmi dlhým reťazcom (VLCAD), ktorá sa podieľa viac ako 80 % na dehydrogenačnej aktivite palmitoyl-CoA v ľudských tkanivách [77]. Zaujímavé je, že Hurd a spol. [78] ukázali, že VLCAD obsahuje cysteínové zvyšky, ktoré významne menia svoj redoxný stav po vystavení izolovaných mitochondrií srdca potkana H2O2. Okrem toho S-nitrozylácia myšieho pečeňového VLCAD na Cys238 zlepšuje katalytickú účinnosť enzýmu [79] a je pravdepodobné, že oxidácia toho istého cysteínu môže mať opačný účinok, čo v konečnom dôsledku znižuje účinnosť mitochondriálnej FAO. Je preto možné, že aj keď sa hladiny expresie VLCAD významne nelíšia vo WT, Nrf2-KO alebo Keap1-KO MEF [65], enzýmová aktivita VLCAD by mohla byť nižšia v neprítomnosti Nrf2 v dôsledku vyšších hladín z ROS.
Na základe všetkých týchto zistení možno navrhnúť, že (obr. 3): v neprítomnosti Nrf2 sú hladiny NADPH nižšie v dôsledku zníženej expresie ME1, IDH1, G6PD a PGD. Hladiny redukovaného glutatiónu sú tiež nižšie v dôsledku zníženej expresie enzýmov, ktoré sa podieľajú na jeho biosyntéze a regenerácii a nižších hladín NADPH, ktoré sú potrebné na premenu oxidovaného na redukovanú formu glutatiónu. Nízka expresia ME1 zníži množstvo pyruvátu vstupujúceho do mitochondrií, pričom hlavným zdrojom pyruvátu sa stane glykolýza. Tvorba NADH je pomalšia, čo vedie k zhoršenej aktivite komplexu I a zvýšenej mitochondriálnej produkcii ROS. Redukcia FAD na FADH2 je tiež pomalšia, aspoň čiastočne v dôsledku menej účinnej oxidácie mastných kyselín, čo ohrozuje tok elektrónov z FADH2 do UbQ a do komplexu III. Keďže UbQH2 je aktivátor sukcinátdehydrogenázy [80], spomalenie jeho tvorby môže znížiť aktivitu enzýmu sukcinátdehydrogenázy. Zvýšené hladiny superoxidu a peroxidu vodíka môžu ďalej inhibovať aktivitu komplexu II [81]. Nižšia účinnosť oxidácie mastných kyselín prispieva k zníženej dostupnosti substrátu pre mitochondriálne dýchanie a produkciu ATP pri oxidatívnej fosforylácii. Ako kompenzačný mechanizmus sa zvyšuje glykolýza. ATP syntáza funguje opačne, ako ATPáza, v snahe udržať ?m.
Nrf2 a mitochondriálna biogenéza
Bolo publikované, že v porovnaní s WT majú pečeň Nrf2-KO myší nižší mitochondriálny obsah (ako je určené pomerom mitochondriálnej a jadrovej DNA); toto je ďalej znížené 24-hodinovým hladovaním u myší WT aj Nrf2-KO; na rozdiel od toho, hoci sa nelíši od WT za normálnych podmienok kŕmenia, obsah mitochondrií u myší s vysokou aktivitou Nrf2 nie je ovplyvnený hladovaním [82]. Je zaujímavé, že suplementácia Nrf2 aktivátorom (R)-a-lipoová kyselina [83], [84], [85] podporuje mitochondriálnu biogenézu v 3T3-L1 adipocytoch [86]. Dve triedy jadrových transkripčných regulátorov hrajú rozhodujúcu úlohu v mitochondriálnej biogenéze. Prvou triedou sú transkripčné faktory, ako sú jadrové respiračné faktory11 a 2, ktoré riadia expresiu génov kódujúcich podjednotky piatich respiračných komplexov, mitochondriálne translačné zložky a enzýmy biosyntézy hemu, ktoré sú lokalizované v mitochondriálnej matrici [88]. Piantadosi a kol. [89] ukázali, že transkripčná upregulácia jadrového respiračného faktora 2 závislá od Nrf1 podporuje mitochondriálnu biogenézu a chráni pred cytotoxicitou kardiotoxického antracyklínového chemoterapeutika doxorubicínu. Na rozdiel od toho Zhang a kol. [82] uviedli, že genetická aktivácia Nrf2 neovplyvňuje bazálnu expresiu mRNA jadrového respiračného faktora 1 v myšacej pečeni.
Druhou triedou jadrových transkripčných regulátorov s kritickými funkciami v mitochondriálnej biogenéze sú transkripčné koaktivátory, ako je receptor aktivovaný peroxizómovým proliferátorom? koaktivátory (PGC)1? a 1p, ktoré interagujú s transkripčnými faktormi, bazálnym transkripčným mechanizmom a mechanizmom zostrihu RNA a enzýmami modifikujúcimi histón [88], [90], [91]. Expresia skupiny koaktivátorov PGC1 je ovplyvnená mnohými environmentálnymi signálmi. Liečba ľudských fibroblastov aktivátorom Nrf2 sulforafanom spôsobuje zvýšenie mitochondriálnej hmoty a indukciu PGC1? a PGC1? [92], hoci potenciálna závislosť od Nrf2 nebola v tejto štúdii skúmaná. Avšak diabetické myši, u ktorých je Nrf2 buď aktivovaný hypomorfným knockdownom génu Keap1 (db/db:Keap1flox/?:Nrf2+/+) alebo narušený (db/db:Keap1flox/?:Nrf2?/?), majú nižšie pečeňové PGC1? úrovne expresie ako kontrolné zvieratá (db/db:Keap1flox/+:Nrf2+/+) [93]. Žiadne rozdiely v hladinách mRNA pre PGC1? sú pozorované v pečeni nediabetických myší, ktoré sú buď WT alebo Nrf2-KO, zatiaľ čo tieto hladiny sú nižšie u zvierat s nadmernou expresiou Nrf2 (Keap1-KD a Keap1-KO špecifický pre pečeň) [82]. Je pozoruhodné, že 24-hodinový pôst zvyšuje hladiny PGC1? mRNA v pečeni myší všetkých genotypov, ale zvýšenie je výrazne väčšie v pečeni Nrf2-KO v porovnaní s myšami s nadmernou expresiou WT alebo Nrf2. V porovnaní s WT myši Nrf2-KO so septickou infekciou alebo akútnym poškodením pľúc v dôsledku infekcie vykazujú zoslabenú transkripčnú upreguláciu jadrového respiračného faktora 1 a PGC1? [94], [95]. Tieto pozorovania spoločne naznačujú, že úloha Nrf2 pri udržiavaní hladín jadrového respiračného faktora 1 a PGC1? je zložitý a najvýraznejší sa stáva v podmienkach stresu.
Okrem expresie génov kódujúcich mitochondriálne proteíny si mitochondriálna biogenéza vyžaduje syntézu nukleotidov. Genetická aktivácia Nrf2 zvyšuje biosyntézu purínov zvýšením regulácie pentózofosfátovej dráhy a metabolizmu folátu a glutamínu, najmä v rýchlo proliferujúcich bunkách (obr. 2) [24]. Analýza transkriptómu mutantnej Drosophila s deficitom mitochondriálnej serín/treonínovej proteínkinázy PTEN-indukovanej predpokladanej kinázy 1 (PINK1) ukázala, že mitochondriálna dysfunkcia vedie k transkripčnej upregulácii génov ovplyvňujúcich metabolizmus nukleotidov [96], čo naznačuje, že zvýšená biosyntéza nukleotidov predstavuje mechanizmus ochrany pred neurotoxickými následkami nedostatku PINK1. Nrf2 reguluje expresiu fosforibozylpyrofosfátamidotransferázy (PPAT), ktorá katalyzuje vstup do de novo biosyntetickej dráhy purínového nukleotidu, a mitochondriálnej metyléntetrahydrofolátdehydrogenázy 2 (MTHFD2) (obr. 2). Posledne menovaný je bifunkčný enzým s dehydrogenázovou a cyklohydrolázovou aktivitou, ktorý je rozhodujúci pri poskytovaní glycínu aj formiátu ako zdrojov jednouhlíkových jednotiek na biosyntézu purínov v rýchlo rastúcich bunkách [97]. Je preto pravdepodobné, že aktivácia Nrf2 môže byť ochranná a môže zvrátiť mitochondriálnu dysfunkciu pri deficite PINK1. Farmakologická aktivácia Nrf2 sulforafanom alebo triterpenoidom RTA-408 skutočne obnovuje µm a chráni bunky s deficitom PINK1 pred dopamínovou toxicitou [98]. Aj keď sa zdá, že základné mechanizmy sú zložité, tieto zistenia spolu naznačujú, že aktivita Nrf2 môže ovplyvniť mitochondriálnu biogenézu ovplyvnením hladín expresie kritických transkripčných faktorov a koaktivátorov, ako aj zvýšením biosyntézy nukleotidov.
Nrf2 a mitochondriálna integrita
Hoci priamy dôkaz nie je vždy dostupný, existujú silné náznaky, že Nrf2 je dôležitý pre mitochondriálnu integritu, najmä v podmienkach oxidačného stresu. Mitochondrie izolované z mozgu a pečene potkanov, ktorým bola podaná jednorazová dávka aktivátora Nrf2 sulforafanu, sú odolné voči otvoreniu mitochondriálneho priepustného prechodového póru (mPTP) spôsobeného oxidantom terc-butylhydroperoxid [99], [100]. Nedávno sa zistilo, že mPTP, komplex, ktorý umožňuje, aby sa vnútorná membrána mitochondrií stala priepustnou pre molekuly s hmotnosťou do 1500 Da, sa tvorí z dimérov F0F1-ATP syntázy [101]. Sulfirafánom sprostredkovaná rezistencia na otvorenie mPTP koreluje so zvýšenou antioxidačnou obranou a hladiny mitochondriálneho GSH, glutatiónperoxidázy 1, jablčného enzýmu 3 a tioredoxínu 2 sú všetky upregulované v mitochondriálnych frakciách izolovaných zo zvierat liečených sulforafanom [100].
Poškodenie mitochondriálneho proteínu a zhoršenie dýchania spôsobené produktom elektrofilnej peroxidácie lipidov 4-hydroxy-2-nonenalom sú oslabené v mitochondriách izolovaných z mozgovej kôry myší liečených sulforafanom [102]. V renálnych epiteliálnych bunkách potkanov a v obličkách sulforafan chráni pred toxicitou vyvolanou cisplatinou a gentamicínom a stratou µm[103], [104]. Ochrana pred skupinou oxidantov (superoxid, peroxid vodíka, peroxydusitan) a elektrofilmi (4-hydroxy-2-nonenal a akroleín) a zvýšenie mitochondriálnej antioxidačnej obrany bola tiež pozorovaná pri liečbe buniek hladkého svalstva potkanej aorty sulforafanom [105 ]. V modeli akútneho poškodenia obličiek vyvolaného kontrastom sa nedávno ukázalo, že predkondicionovanie ischemickej končatiny má ochranné účinky, vrátane inhibície otvorenia mPTP a mitochondriálneho opuchu, aktiváciou Nrf2 v dôsledku inhibície GSK3? [106].
Mitofágia, proces, ktorým sú dysfunkčné mitochondrie selektívne pohltené autofagozómami a dodávané do lyzozómov, aby boli degradované a recyklované bunkou, je nevyhnutný pre mitochondriálnu homeostázu [107], [108]. Zatiaľ čo nebol stanovený žiadny príčinný vzťah medzi Nrf2 a mitofágiou, existujú dôkazy, že transkripčný faktor môže byť dôležitý pri kontrole mitochondriálnej kvality tým, že hrá úlohu v mitofágii. To môže byť obzvlášť výrazné v podmienkach oxidačného stresu. V modeli sepsy je teda zvýšenie hladín autofagozómového markera MAP1 ľahkého reťazca 3-II (LC3-II) a cargo proteínu p62 po 24 hodinách po infekcii u Nrf2-KO v porovnaní s myšami WT potlačené [109]. . Nedávno bol objavený induktor mitofágie s malou molekulou (nazývaný induktor mitofágie sprostredkovaný p62, PMI); táto 1,4-difenyl-1,2,3-triazolová zlúčenina bola pôvodne navrhnutá ako aktivátor Nrf2, ktorý narúša interakciu transkripčného faktora s Keap1 [110]. Podobne ako bunky, v ktorých je Nrf2 geneticky upregulovaný (Keap1-KD alebo Keap1-KO), bunky vystavené PMI majú vyšší pokojový ?m. Dôležité je, že zvýšenie mitochondriálnej lokalizácie LC3, ktoré sa pozoruje po ošetrení buniek WT PMI, sa nevyskytuje v bunkách Nrf2-KO, čo naznačuje zapojenie Nrf2.
Nakoniec ultraštrukturálna analýza pečeňových rezov odhalila prítomnosť opuchnutých mitochondrií so zníženou kristou a narušenými membránami v hepatocytoch myší Nrf2-KO, ale nie WT, ktoré boli 24 týždňov kŕmené stravou s vysokým obsahom tukov; najmä tieto pečene vykazujú jasný dôkaz oxidačného stresu a zápalu [68]. Možno konštatovať, že Nrf2 má rozhodujúcu úlohu pri udržiavaní mitochondriálnej integrity v podmienkach oxidačného a zápalového stresu.
Sulforaphane a jeho účinky na rakovinu, úmrtnosť, starnutie, mozog a správanie, srdcové choroby a ďalšie
Izotiokyanáty sú niektoré z najdôležitejších rastlinných zlúčenín, ktoré môžete získať vo svojej strave. V tomto videu pre nich robím najkomplexnejší prípad, aký kedy bol vyrobený. Krátka doba pozornosti? Preskočte na svoju obľúbenú tému kliknutím na jeden z časových bodov nižšie. Úplná časová os nižšie.
Kľúčové sekcie:
- 00:01:14 – Rakovina a úmrtnosť
- 00:19:04 – Starnutie
- 00:26:30 – Mozog a správanie
- 00:38:06 – Záverečná rekapitulácia
- 00:40:27 – Dávka
Úplná časová os:
- 00:00:34 – Predstavenie sulforafanu, hlavné zameranie videa.
- 00:01:14 – Spotreba krížovej zeleniny a zníženie úmrtnosti zo všetkých príčin.
- 00:02:12 – Riziko rakoviny prostaty.
- 00:02:23 – Riziko rakoviny močového mechúra.
- 00:02:34 – Riziko rakoviny pľúc u fajčiarov.
- 00:02:48 – Riziko rakoviny prsníka.
- 00:03:13 – Hypotetické: čo ak už máte rakovinu? (intervenčné)
- 00:03:35 – Pravdepodobný mechanizmus, ktorý riadi asociatívne údaje o rakovine a úmrtnosti.
- 00:04:38 – Sulforafán a rakovina.
- 00:05:32 – Dôkazy na zvieratách ukazujúce silný účinok extraktu z výhonkov brokolice na vývoj nádoru močového mechúra u potkanov.
- 00:06:06 – Účinok priamej suplementácie sulforafanu u pacientov s rakovinou prostaty.
- 00:07:09 – Bioakumulácia izotiokyanátových metabolitov v aktuálnom prsnom tkanive.
- 00:08:32 – Inhibícia kmeňových buniek rakoviny prsníka.
- 00:08:53 – Lekcia dejepisu: Brassica bola preukázaná ako zdraviu prospešné už v starovekom Ríme.
- 00:09:16 – Schopnosť sulforafanu zvyšovať vylučovanie karcinogénov (benzén, akroleín).
- 00:09:51 – NRF2 ako genetický prepínač prostredníctvom prvkov antioxidačnej odozvy.
- 00:10:10 – Ako aktivácia NRF2 zvyšuje vylučovanie karcinogénu cez glutatión-S-konjugáty.
- 00:10:34 – Ružičkový kel zvyšuje glutatión-S-transferázu a znižuje poškodenie DNA.
- 00:11:20 – Nápoj z brokolicových klíčkov zvyšuje vylučovanie benzénu o 61 %.
- 00:13:31 – Homogenát brokolicových klíčkov zvyšuje antioxidačné enzýmy v horných dýchacích cestách.
- 00:15:45 – Spotreba krížovej zeleniny a úmrtnosť na srdcové choroby.
- 00:16:55 – Prášok z brokolicových klíčkov zlepšuje krvné lipidy a celkové riziko srdcových chorôb u diabetikov 2. typu.
- 00:19:04 – Začiatok úseku starnutia.
- 00:19:21 – Diéta obohatená o sulforafan zvyšuje životnosť chrobákov z 15 na 30 % (za určitých podmienok).
- 00:20:34 – Význam nízkeho zápalu pre dlhovekosť.
- 00:22:05 – Zdá sa, že krížová zelenina a prášok z brokolicových klíčkov znižujú množstvo zápalových markerov u ľudí.
- 00:23:40 – Rekapitulácia v polovici videa: rakovina, starnutie
- 00:24:14 – Štúdie na myšiach naznačujú, že sulforafan môže zlepšiť adaptívnu imunitnú funkciu v starobe.
- 00:25:18 – Sulforaphane zlepšil rast vlasov u myšieho modelu plešatenia. Snímka o 00:26:10.
- 00:26:30 – Začiatok sekcie mozog a správanie.
- 00:27:18 – Vplyv extraktu z brokolicových klíčkov na autizmus.
- 00:27:48 – Účinok glukorafanínu na schizofréniu.
- 00:28:17 – Začiatok diskusie o depresii (pravdepodobný mechanizmus a štúdie).
- 00:31:21 – Štúdia na myšiach s použitím 10 rôznych modelov depresie vyvolanej stresom ukazuje, že sulforafan je podobne účinný ako fluoxetín (prozac).
- 00:32:00 – Štúdia ukazuje, že priame požitie glukorafanínu u myší je podobne účinné pri prevencii depresie zo sociálneho modelu stresu.
- 00:33:01 – Začiatok sekcie neurodegenerácie.
- 00:33:30 – Sulforafán a Alzheimerova choroba.
- 00:33:44 – Sulforaphane a Parkinsonova choroba.
- 00:33:51 - Sulforaphane a Hungtingtonova choroba.
- 00:34:13 – Sulforaphane zvyšuje proteíny tepelného šoku.
- 00:34:43 – Začiatok sekcie traumatického poranenia mozgu.
- 00:35:01 – Sulforaphane podaný ihneď po TBI zlepšuje pamäť (štúdia na myšiach).
- 00:35:55 – Sulforafán a plasticita neurónov.
- 00:36:32 – Sulforaphane zlepšuje učenie v modeli diabetu typu II u myší.
- 00:37:19 – Sulforaphane a Duchennova svalová dystrofia.
- 00:37:44 – Inhibícia myostatínu vo svalových satelitných bunkách (in vitro).
- 00:38:06 – Neskoré video rekapitulácia: úmrtnosť a rakovina, poškodenie DNA, oxidačný stres a zápal, vylučovanie benzénu, kardiovaskulárne ochorenia, diabetes typu II, účinky na mozog (depresia, autizmus, schizofrénia, neurodegenerácia), dráha NRF2.
- 00:40:27 – Myšlienky na to, ako zistiť dávku brokolicových klíčkov alebo sulforafanu.
- 00:41:01 – Anekdoty o klíčení doma.
- 00:43:14 – O teplotách varenia a aktivite sulforafanu.
- 00:43:45 – Premena sulforafanu z glukorafanínu črevnými baktériami.
- 00:44:24 – Doplnky fungujú lepšie v kombinácii s aktívnou myrozinázou zo zeleniny.
- 00:44:56 – Techniky varenia a krížová zelenina.
- 00:46:06 – Izotiokyanáty ako struma.

Nrf2 je transkripčný faktor, ktorý hrá dôležitú úlohu v bunkovom antioxidačnom obrannom systéme ľudského tela. Prvok reagujúci na antioxidant alebo ARE je regulačný mechanizmus génov. Mnohé výskumné štúdie preukázali, že Nrf2 alebo faktor 2 súvisiaci s NF-E2 reguluje širokú škálu génov riadených ARE v niekoľkých typoch buniek. Zistilo sa tiež, že Nrf2 hrá zásadnú úlohu pri bunkovej ochrane a antikarcinogenite, čo dokazuje, že Nrf2 môže byť účinnou liečbou pri liečbe neurodegeneratívnych ochorení a rakovín, o ktorých sa predpokladá, že sú spôsobené oxidačným stresom. Dr. Alex Jimenez DC, CCST Insight
Záverečné poznámky
Aj keď veľa otázok zostáva stále otvorených, dostupné experimentálne dôkazy jasne naznačujú, že Nrf2 je dôležitým hráčom pri udržiavaní mitochondriálnej homeostázy a štrukturálnej integrity. Táto úloha sa stáva obzvlášť kritickou v podmienkach oxidačného, elektrofilného a zápalového stresu, keď schopnosť upregulovať cytoprotektívne reakcie sprostredkované Nrf2 ovplyvňuje celkové zdravie a prežitie bunky a organizmu. Úloha Nrf2 v mitochondriálnej funkcii predstavuje ďalšiu vrstvu širokých cytoprotektívnych mechanizmov riadených týmto transkripčným faktorom. Pretože mnohé ľudské patologické stavy majú oxidačný stres, zápal a mitochondriálnu dysfunkciu ako základné zložky ich patogenézy, farmakologická aktivácia Nrf2 je prísľubom pre prevenciu a liečbu chorôb. Komplexné pochopenie presných mechanizmov, ktorými Nrf2 ovplyvňuje mitochondriálnu funkciu, je nevyhnutné pre racionálny návrh budúcich klinických štúdií a môže ponúknuť nové biomarkery na monitorovanie terapeutickej účinnosti.
Poďakovanie
Sciencedirect.com/science/article/pii/S0891584915002129
Účelom vyššie uvedeného článku bolo diskutovať, ako aj demonštrovať vznikajúcu úlohu Nrf2 v mitochondriálnej funkcii. Nrf2, príp jadrový faktor erytroidný 2-príbuzný faktorje novým regulátorom bunkovej rezistencie voči oxidantom, ktorý môže prispievať k oxidačnému stresu, ovplyvňuje bunkovú funkciu a vedie k rozvoju toxicity, chronických ochorení a dokonca aj rakoviny. Zatiaľ čo produkcia oxidantov v ľudskom tele môže slúžiť na rôzne účely, vrátane bunkového delenia, zápalu, imunitnej funkcie, autofágie a stresovej reakcie, je nevyhnutné kontrolovať ich nadprodukciu, aby sa predišlo zdravotným problémom. Rozsah našich informácií je obmedzený na chiropraktické a zdravotné problémy chrbtice. Ak chcete prediskutovať túto tému, neváhajte sa opýtať Dr. Jimeneza alebo nás kontaktujte na adrese�915-850-0900 .
Kurátorom je Dr. Alex Jimenez
Odkazované z: Sciencedirect.com

Ďalšia téma diskusie:�Akútna bolesť chrbta
Bolesti chrbta�je jednou z najčastejších príčin invalidity a vymeškaných dní v práci na celom svete. Bolesti chrbta sú druhým najčastejším dôvodom návštevy lekára, prevyšujú ho iba infekcie horných dýchacích ciest. Približne 80 percent populácie aspoň raz za život zažije bolesť chrbta. Chrbtica je komplexná štruktúra pozostávajúca z kostí, kĺbov, väzov a svalov, okrem iných mäkkých tkanív. Z tohto dôvodu môžu zranenia a/alebo zhoršené stavy, ako naprherné disky, môže nakoniec viesť k príznakom bolesti chrbta. Športové zranenia alebo zranenia pri automobilových nehodách sú často najčastejšou príčinou bolesti chrbta, niekedy však môžu mať aj tie najjednoduchšie pohyby bolestivé následky. Našťastie alternatívne možnosti liečby, ako je chiropraktická starostlivosť, môžu pomôcť zmierniť bolesť chrbta pomocou úprav chrbtice a manuálnych manipulácií, čo v konečnom dôsledku zlepšuje úľavu od bolesti. �

EXTRA EXTRA | DÔLEŽITÁ TÉMA: Odporúčaný El Paso, TX Chiropraktik
***
Informácie tu uvedené o „Vznikajúca úloha Nrf2 v mitochondriálnej funkcii" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka