sulforafan je fytochemikália, látka patriaca do izotiokyanátovej skupiny organosírových zlúčenín, ktorá sa nachádza v krížovej zelenine, ako je brokolica, kapusta, karfiol a ružičkový kel. Možno ho nájsť aj v bok choy, keli, obojkoch, horčicoch a žeruche. Výskumné štúdie ukázali, že sulforafan môže pomôcť predchádzať rôznym typom rakoviny aktivácia produkcie Nrf2alebo nukleárny faktor erytroidný 2-príbuzný faktor, transkripčný faktor, ktorý reguluje ochranné antioxidačné mechanizmy, ktoré riadia odpoveď bunky na oxidanty. Účelom nasledujúceho článku je opísať funkciu sulforafanu.
Obsah
abstraktné
Antioxidačný systém KEAP1-Nrf2-ARE je hlavným prostriedkom, ktorým bunky reagujú na oxidačný a xenobiotický stres. Sulforaphane (SFN), elektrofilný izotiokyanát získaný z krížovej zeleniny, aktivuje dráhu KEAP1-Nrf2-ARE a stal sa predmetom záujmu pri liečbe chorôb, pri ktorých zohráva hlavnú etiologickú úlohu chronický oxidačný stres. Tu demonštrujeme, že mitochondrie kultivovaných buniek ľudského retinálneho pigmentového epitelu (RPE-1) ošetrených SFN podliehajú hyperfúzii, ktorá je nezávislá od Nrf2 a jeho cytoplazmatického inhibítora KEAP1. Uvádza sa, že mitochondriálna fúzia je cytoprotektívna inhibíciou tvorby pórov v mitochondriách počas apoptózy, a v súlade s tým ukazujeme cytoprotekciu buniek ošetrených SFN vystavených induktoru apoptózy, staurosporínu, nezávislú od Nrf2. Mechanicky SFN zmierňuje nábor a / alebo retenciu rozpustného štiepneho faktora Drp1 do mitochondrií a peroxizómov, ale neovplyvňuje celkové množstvo Drp1. Tieto údaje ukazujú, že prospešné vlastnosti SFN presahujú aktiváciu systému KEAP1-Nrf2-ARE a vyžadujú ďalšie vypočúvanie vzhľadom na súčasné použitie tohto činidla vo viacerých klinických štúdiách.
Kľúčové slová: Sulforaphane, Nrf2, Drp1, mitochondrie, štiepenie, fúzia, apoptóza
úvod
Sulforaphane je Nrf2-nezávislý inhibítor mitochondriálneho štiepenia
Sulforafán (SFN) je izotiokyanátová zlúčenina získavaná v strave najčastejšie z krížovej zeleniny [56]. Vytvára sa v rastlinách ako xenobiotická reakcia na predáciu prostredníctvom vezikulárneho uvoľňovania hydrolytického enzýmu myrozinázy z poškodených buniek; tento enzým premieňa glukozinoláty na izotiokyanty [42]. Počas posledných dvoch desaťročí bol SFN značne charakterizovaný pre svoje protirakovinové, antioxidačné a antimikrobiálne vlastnosti [57]. Veľká časť tejto účinnosti sa pripisuje schopnosti SFN modulovať signálnu dráhu KEAP1-Nrf2-antioxidant response element (ARE), hoci boli identifikované ďalšie aktivity zlúčeniny, vrátane inhibície aktivity históndeacetylázy a progresie bunkového cyklu. 29]. Nrf2 je hlavný antioxidačný transkripčný faktor a v podmienkach homeostázy je jeho stabilita potlačená pôsobením cytoplazmatického komplexu ubikvitín ligázy Cullin3KEAP1 [20]. Konkrétne sa Nrf2 získava do ligázy Cullin3KEAP1 väzbou na dimérny substrátový adaptér KEAP1 a následne sa modifikuje reťazcami polyUb, ktoré sa zameriavajú na transkripčný faktor na degradáciu sprostredkovanú proteazómom. Tento konštitutívny obrat obmedzuje polčas Nrf2 v nestresovaných bunkách na ~15 minút [30], [33], [46], [55]. V reakcii na mnohé typy stresu, najmä oxidačný stres, KEAP1, proteín bohatý na cysteín, pôsobí ako redoxný senzor a oxidačná modifikácia kritických cysteínov, najmä C151, KEAP1 disociuje Nrf2-KEAP1 od CUL3, čím zabraňuje degradácii Nrf2 [ 8], [20], [55]. Najmä SFN a možno aj iné aktivátory Nrf2 napodobňujú oxidačný stres modifikáciou C151 z KEAP1, napr. [21]. Stabilizácia Nrf2 umožňuje jeho translokáciu do jadra, kde indukuje expresiu batérie fázy II antioxidačných a detoxikačných génov. Nrf2 sa viaže na promótorové prvky antioxidačnej odozvy (ARE) svojich príbuzných cieľových génov prostredníctvom heterodimerizácie s malými proteínmi Maf [19]. Tento systém predstavuje dynamickú a citlivú odpoveď na nepriame antioxidanty, ako je SFN, voľné radikály generované mitochondriami [16] alebo iné fyziologické zdroje oxidačného stresu [41].
Mitochondrie sú dynamické subcelulárne organely, ktoré regulujú množstvo bunkových funkcií od produkcie ATP a intracelulárneho tlmenia vápnika až po redoxnú reguláciu a apoptózu [13], [49]. Mitochondrie tiež predstavujú hlavný zdroj reaktívnych foriem kyslíka (ROS) v bunke. Správna regulácia mitochondriálnej funkcie je preto nevyhnutná na optimalizáciu produkcie ATP na uspokojenie bunkových potrieb pri súčasnej minimalizácii potenciálne škodlivých účinkov nadmernej produkcie voľných radikálov. Kritickou požiadavkou na jemnú moduláciu mitochondriálnej funkcie je schopnosť mitochondrií fungovať nezávisle ako biochemické stroje a ako súčasť rozsiahlej, responzívne siete.
Morfológia a funkcia mitochondriálnej siete sú určené regulovanou rovnováhou medzi štiepením a fúziou. Mitochondriálne štiepenie je potrebné pre dedičnosť mitochondrií dcérskymi bunkami počas bunkového delenia [28], ako aj pre selektívnu, autofagickú degradáciu depolarizovaných alebo poškodených mitochondrií, nazývanú mitofágia [1]. Naopak, fúzia je potrebná na komplementáciu mitochondriálnych genómov a zdieľanie komponentov transportného reťazca elektrónov medzi susednými mitochondriami [54]. Na molekulárnej úrovni sú mitochondriálne štiepenie a fúzia regulované veľkými, dynamínu podobnými GTPázami. Tri enzýmy primárne regulujú fúziu: mitofusíny 1 a 2 (Mfn1/2) sú dvojpriechodové proteíny vonkajšej membrány, ktoré sprostredkúvajú fúziu vonkajšej membrány prostredníctvom heterotypických interakcií medzi susednými mitochondriami [15], [25], [37], zatiaľ čo OPA1 je vnútorný membránový proteín, ktorý súčasne zabezpečuje konektivitu matrice reguláciou splynutia vnútorných membrán [5]. Aktivita GTPázy všetkých troch proteínov je potrebná na robustnú fúziu [5], [18] a OPA1 je ďalej regulovaný komplexnou proteolýzou v mitochondriálnej vnútornej membráne proteázami OMA1 [14], PARL [6] a YME1L [45 ]. Dôležité je, že pre účinnú fúziu je potrebný neporušený mitochondriálny membránový potenciál, aby sa potlačila integrácia poškodených a zdravých mitochondrií [26].
Mitochondriálne štiepenie je primárne katalyzované cytosolickým proteínom nazývaným Dynamin-related protein 1 (Drp1/DNM1L). Drp1 sa rekrutuje z cytosolu do perspektívnych miest štiepenia na mitochondriálnej vonkajšej membráne [43]. Hlavnými receptormi pre Drp1 na vonkajšej membráne sú mitochondriálny štiepny faktor (Mff) [32] a v menšej miere štiepny faktor 1 (Fis1) [51]. Okrem toho bol objavený návnadový receptor MIEF1/MiD51, ktorý ďalej obmedzuje aktivitu proteínu Drp1 na potenciálnych miestach štiepenia [58]. Po ukotvení na mitochondriálnej vonkajšej membráne sa Drp1 oligomerizuje do špirálovitých štruktúr okolo tela mitochondrie a potom využíva energiu odvodenú z hydrolýzy GTP na sprostredkovanie fyzického štiepenia mitochondriálnych vonkajších a vnútorných membrán [17]. Tubuly odvodené od endoplazmatického retikula pôsobia ako počiatočný konstriktor mitochondrií pred oligomerizáciou Drp1, čo podčiarkuje odhalenie, že nezúžené mitochondrie sú širšie ako permisívny obvod dokončenej špirály Drp1 [12]. Dynamika aktínu je dôležitá aj pre interakcie ER-mitochondrie, ktoré predchádzajú mitochondriálnemu štiepeniu [24]. Okrem svojej úlohy v mitochondriálnom štiepení, Drp1 katalyzuje štiepenie peroxizómov [40].
Drp1 je veľmi podobný dobre charakterizovanému dynamínovému proteínu v tom, že oba proteíny obsahujú N-koncovú doménu GTPázy, strednú doménu, ktorá je kritická pre autooligomerizáciu, a C-koncovú efektorovú doménu GTPázy [31]. Drp1 dosahuje selektivitu pre mitochondriálne membrány prostredníctvom kombinácie interakcií so svojimi receptorovými proteínmi Mff a Fis1 a tiež prostredníctvom svojej afinity k mitochondriálne špecifickému fosfolipidovému kardiolipínu prostredníctvom unikátnej B-inzertnej domény Drp1 [2]. Drp1 typicky existuje ako homotetramér v cytoplazme a zostavenie vyššieho rádu v miestach mitochondriálneho štiepenia je sprostredkované strednou doménou Drp1 [3].
Vzhľadom na implicitné spojenie medzi mitochondriálnou funkciou a dráhou KEAP1-Nrf2-ARE sme skúmali účinky aktivácie Nrf2 na mitochondriálnu štruktúru a funkciu. Tu demonštrujeme, že SFN indukuje mitochondriálnu hyperfúziu, ktorá je neočakávane nezávislá od Nrf2 aj KEAP1. Tento účinok SFN je prostredníctvom inhibície funkcie Drp1. Ďalej demonštrujeme, že SFN prepožičiava rezistenciu voči apoptóze, ktorá je nezávislá od Nrf2 a napodobňuje, ktorá sa pozoruje v bunkách zbavených Drp1. Tieto údaje súhrnne naznačujú, že okrem stabilizácie a aktivácie Nrf2, SFN moduluje mitochondriálnu dynamiku a zachováva bunkovú zdatnosť a prežitie.
výsledky
Sulforaphane indukuje Nrf2/KEAP1-nezávislú hyperfúziu mitochondrií
V priebehu štúdia účinkov aktivácie Nrf2 na dynamiku mitochondriálnej siete sme zistili, že ošetrenie imortalizovaných buniek ľudského retinálneho pigmentového epitelu (RPE-1) sulforafanom (SFN), silným aktivátorom signalizácie Nrf2, vyvolalo silnú fúziu mitochondriálnej siete v porovnaní s kontrolnými bunkami ošetrenými vehikulom (obr. 1A a B). Morfológia mitochondrií v týchto bunkách sa veľmi podobala morfológii mitochondrií v bunkách vyčerpaných siRNA endogénneho Drp1, hlavného mitochondriálneho štiepneho faktora (obr. 1A). Tento výsledok vyvolal zaujímavú myšlienku, že stav mitochondriálneho štiepenia a fúzie priamo reaguje na hladiny Nrf2 v bunke. Stimulácia buniek inými stabilizátormi a aktivátormi Nrf2, ako je inhibítor proteazómu MG132, prooxidačný tBHQ alebo knockdown inhibítora Nrf2 KEAP1, však neindukovali mitochondriálnu fúziu (obr. 1A a B). Stabilizácia Nrf2 týmito manipuláciami bola potvrdená westernovým prenosom pre endogénny Nrf2 (obr. 1C). Okrem toho bola expresia Nrf2 nevyhnutná pre mitochondriálnu fúziu indukovanú SFN, pretože knockdown endogénneho Nrf2 pomocou siRNA nedokázal čeliť tomuto fenotypu (obr. 1D�F). Pretože SFN stimuluje dráhu KEAP1-Nrf2-ARE kovalentnou modifikáciou cysteínových zvyškov KEAP1 [21], zrazili sme KEAP1, aby sme vyriešili, či je mitochondriálna hyperfúzia indukovaná SFN stimulovaná prostredníctvom dráhy závislej od KEAP1, ale nezávislej od Nrf2. Deplécia KEAP1 však tiež nedokázala zrušiť mitochondriálnu fúziu indukovanú SFN (obr. 1G�I). V skutočnosti SFN zvrátil pro-štiepnu morfológiu vyvolanú depléciou KEAP1 (obr. 1G, panel b verzus panel d). Tieto výsledky naznačujú, že liečba SFN spôsobuje mitochondriálnu fúziu nezávislú od kanonickej dráhy KEAP1-Nrf2-ARE a viedli nás k otázke, či SFN priamo ovplyvňuje zložky mitochondriálneho štiepneho alebo fúzneho mechanizmu.
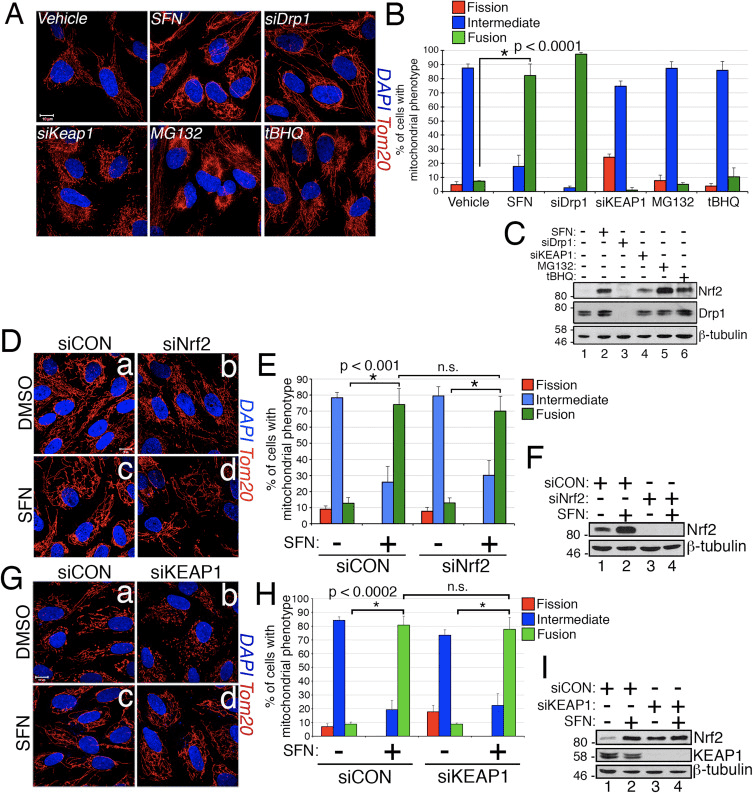
Sulforaphane poškodzuje mitochondriálnu asociáciu Drp1
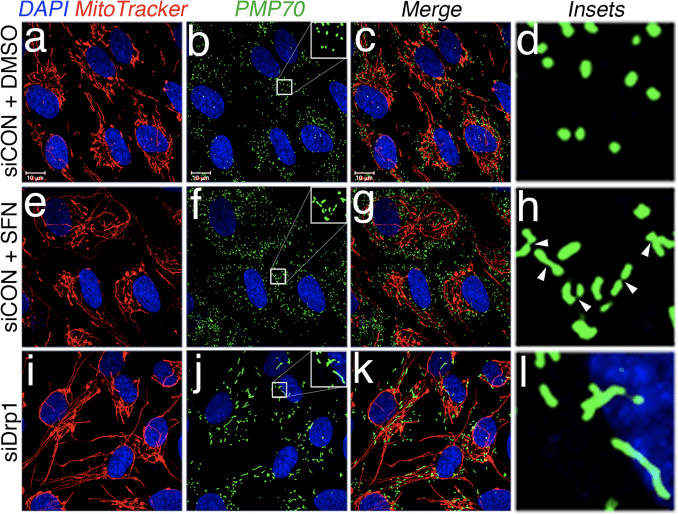
Na základe zistenia, že liečba SFN indukuje mitochondriálnu hyperfúziu, sme usúdili, že tento fenotyp bol buď dôsledkom nadmernej fúznej aktivity alebo inhibície štiepnej aktivity. Aby sme rozlíšili medzi týmito dvoma možnosťami, porovnali sme morfológiu peroxizómov v prítomnosti a neprítomnosti SFN. Peroxizómy sú podobné mitochondriám v tom, že sú to dynamické organely, ktorých tvar a dĺžka sa neustále menia [44]. Peroxizómy obsahujú vo svojej vonkajšej membráne Fis1 aj Mff a v dôsledku toho sú cieľmi pre štiepenie sprostredkované Drp1 [22], [23]. Peroxizómy však nevyužívajú fúzny mechanizmus mitochondriálnej siete, a preto nepodliehajú fúzii [39]. Peroxizomálnemu štiepeniu skôr odporuje predlžovanie existujúcich peroxizómov prostredníctvom de novo pridania membrán a proteínov [44]. Pretože peroxizómom chýba Mfn1/2 a OPA1, usúdili sme, že ak SFN aktivuje fúzny mechanizmus, a nie inhibuje štiepny mechanizmus, dĺžka peroxizómu by nebola ovplyvnená. V bunkách ošetrených vehikulom sú peroxizómy udržiavané ako krátke, okrúhle bodové organely (obr. 2, panely b a d). Ošetrenie SFN však zvýšilo dĺžku peroxizómu ~2-násobne v porovnaní s kontrolnými bunkami (obr. 2, panely f a h). Okrem toho bolo veľa peroxizómov zaseknutých blízko stredu, čo naznačuje potenciálny defekt štiepenia (obr. 2, panel h, šípky). Podobne peroxizómy v bunkách transfekovaných Drp1 siRNA boli abnormálne dlhé (obr. 2, panely j a l), čo potvrdzuje, že Drp1 je potrebný na peroxizomálne štiepenie a naznačuje, že liečba SFN spôsobuje mitochondriálne a peroxizomálne fenotypy narušením štiepneho mechanizmu.
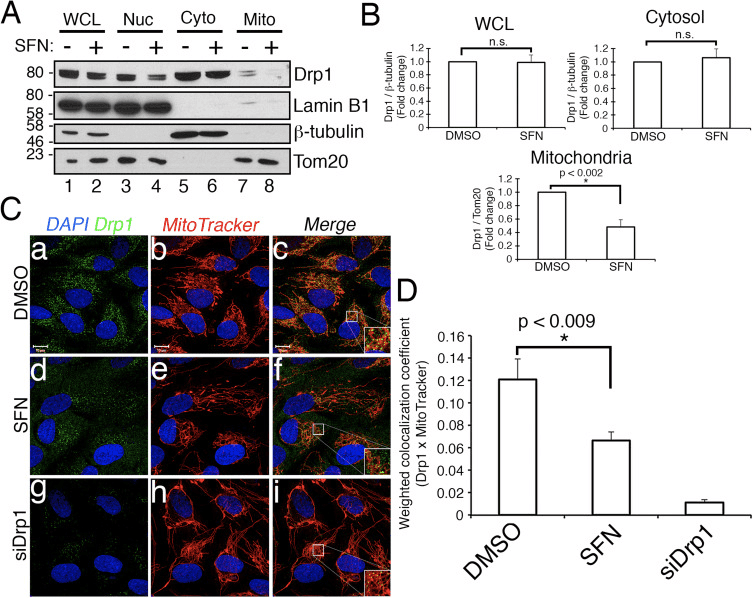
Ďalej sme určili, ako SFN obmedzuje funkciu Drp1. Možnosti zahŕňali zníženie hladín expresie, nábor/zadržanie v mitochondriách, oligomerizáciu alebo enzymatickú aktivitu GTPázy. Deficit ktorejkoľvek z nich by viedol k zníženiu mitochondriálneho štiepenia a hyperfúzie. Nezistili sme reprodukovateľné zmeny v hladinách proteínu Drp1 po liečbe SFN (obr. 1C a 3A), a preto sme dospeli k záveru, že SFN nemení stabilitu alebo expresiu Drp1, čo je v súlade s polčasom Drp1 > 10 hodín [50] a naše SFN liečby majú kratšie trvanie. Ďalej sme skúmali, či SFN ovplyvnil nábor alebo udržanie Drp1 v mitochondriách. Frakčné štúdie ukázali, že SFN vyvolal stratu Drp1 z mitochondriálnej frakcie (obr. 3A, dráhy 7�8 a obr. 3B). Ako už bolo uvedené [43], iba malá časť Drp1 (~3 %) je spojená s mitochondriálnou sieťou v akomkoľvek danom čase počas podmienok ustáleného stavu, pričom väčšina enzýmu sa nachádza v cytoplazme (obr. 3A, pruhy 5�8 ). Tieto údaje o frakcionácii boli potvrdené použitím ko-lokalizačnej analýzy, ktorá ukázala ~40% redukciu v mitochondriách lokalizovaných bodkovaných Drp1 ložísk po liečbe SFN (obr. 3C a D). Tieto údaje spolu naznačujú, že mitochondriálna fúzia indukovaná SFN je aspoň čiastočne spôsobená oslabeným spojením Drp1 s mitochondriami. Naše údaje nerozlišujú medzi tým, či SFN interferuje s mitochondriálnym náborom oproti mitochondriálnej retencii Drp1 alebo oboch, pretože analýza endogénneho Drp1 nebola prístupná na vizualizáciu GTPázy pomocou mikroskopie živých buniek.
Sulforaphane poskytuje ochranu proti apoptóze vyvolanej staurosportínom nezávisle od Nrf2
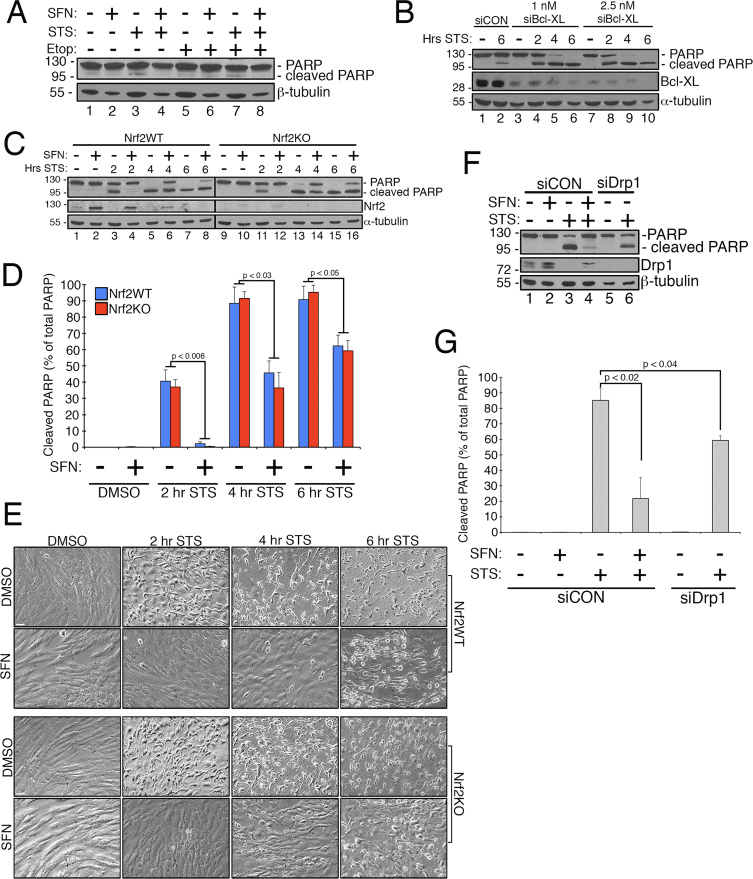
Predchádzajúca práca ukázala, že mitochondriálne štiepenie je permisívne pri tvorbe pórov vo vonkajšej mitochondriálnej membráne generovanej Bax/Bak počas apoptózy [11]. Ukázalo sa, že Drp1 sa selektívne prijíma do mitochondrií počas apoptózy [11] a v súlade s tým boli fragmentované mitochondrie pozorované na začiatku procesu [27]. Naopak, predpokladá sa, že inhibícia mitochondriálneho štiepenia inhibuje apoptózu blokovaním tvorby pórov vonkajšej membrány, ktoré umožňujú uvoľňovanie cytochrómu c [53]. V súlade s tým stimulácia mitochondriálnej fúzie oneskoruje progresiu apoptózy indukovanej zlúčeninami vrátane staurosporínu (STS) [14]. Aby sme určili, či SFN chráni bunky RPE-1 pred apoptózou sprostredkovanou STS, a ak áno, či to vyžaduje Nrf2, zaviedli sme test na ľahké vyvolanie štiepenia poly ADP ribózopolymerázou (PARP), substrát aktivovanej kaspázy-3 a definitívny marker apoptóza. Ošetrenie buniek RPE-1 1 µM STS počas 6 hodín spôsobilo len veľmi mierne štiepenie PARP, ale tomu sa zabránilo spoločnou liečbou SFN (napr. obr. 4A, dráha 3 oproti 4). Aby sme zvýšili robustnosť tohto testu, ďalej sme senzibilizovali bunky na apoptózu indukovanú STS tak, že sme ich vopred ošetrili siRNA zacielenou na antiapoptotický faktor, Bcl-XL. Toto predbežné ošetrenie znížilo expresiu Bcl-XL a výrazne podporilo štiepenie PARP ako funkciu času vystaveného STS (obr. 4B, porovnaj dráhu 2 s dráhou 4-10). Dôležité je, že 2 hodiny predbežného ošetrenia SFN zmiernilo štiepenie PARP v bunkách vystavených STS (obr. 4C, dráha 3 oproti 4 a dráha 5 oproti 6). Podobne bunky stabilne zbavené Nrf2 pomocou CRISPR/Cas9 boli porovnateľne chránené pred STS toxicitou predbežným ošetrením SFN (obr. 4C, dráha 11 oproti 12 a dráha 13 oproti 14 a obrázok 4D). Táto ochrana bola pozorovaná s použitím štiepenia PARP (obr. 4C a D) a bunkovej morfológie (obr. 4E) ako výsledkov. Účinnosť deplécie Nrf2 pomocou CRISPR/Cas9 bola potvrdená westernovým prenosom (obr. 4C, Nrf2 blot). Ako sa predpokladalo, vyčerpanie buniek Drp1, ktoré tiež poskytuje hyperfúzny fenotyp (obr. 1A), tiež blokovalo štiepenie PARP v reakcii na STS v porovnaní s kontrolnými bunkami inkubovanými s SFN (obr. 4F a G). Spoločne sú tieto zistenia v súlade s tým, že SFN poskytuje ochranu proti apoptóze prostredníctvom svojej schopnosti obmedziť funkciu Drp1, nezávisle od stabilizácie a aktivácie Nrf2.
Diskusia
Zistili sme, že SFN moduluje dynamiku mitochondriálneho štiepenia/fúzie nezávisle od jeho účinkov na dráhu KEAP1-Nrf2-ARE. To je zaujímavé z dôvodu predpokladaného spojenia medzi mitochondriálnou dysfunkciou a produkciou ROS a potrebou potlačenia voľných radikálov odvodených od mitochondrií prostredníctvom aktivácie Nrf2. Tento dodatočný funkčný vplyv SFN má potenciálny význam vzhľadom na viac ako 30 klinických štúdií, ktoré v súčasnosti testujú SFN na liečbu rôznych chorôb vrátane rakoviny prostaty, obštrukčnej choroby pľúc a kosáčikovitej anémie [7], [10], [ 47].
Pretože SFN je izotiokyanát [56] a aktivuje signalizáciu Nrf2 priamou acyláciou kritických cysteínov KEAP1 na potlačenie degradácie Nrf2 [21], vyplýva, že SFN uplatňuje svoje profúzne účinky moduláciou aktivity štiepneho alebo fúzneho faktora prostredníctvom modifikácie cysteínu. . Naše údaje silne podporujú, že Drp1 je negatívne regulovaný SFN, aj keď je potrebné objasniť, či je GTPáza priamym cieľom acylácie. Napriek tejto medzere vo vedomostiach je funkcia Drp1 jasne ohrozená SFN, pretože mitochondrie aj peroxizómy sa hyperfúzujú v reakcii na liečbu SFN a tieto organely zdieľajú Drp1 pre ich príslušné štiepne udalosti [38]. Okrem toho SFN znižuje množstvo Drp1, ktoré sa lokalizuje a akumuluje v mitochondriách (obr. 3). Pretože naše experimenty boli vykonané so všetkými endogénnymi proteínmi, naša detekcia Drp1 v miestach mitochondriálneho štiepenia je v podmienkach ustáleného stavu, a preto nemôžeme rozlíšiť medzi náborom a retenčným defektom enzýmu spôsobeným SFN. Ďalej nemôžeme vylúčiť možnosť, že SFN acyluje receptor v mitochondriách (Fis1 alebo Mff), aby blokoval nábor Drp1, máme podozrenie, že Drp1 je priamo modifikovaný. Drp1 má deväť cysteínov, z ktorých osem sa nachádza v strednej doméne, ktorá je potrebná na oligomerizáciu [3], a jeden z nich sa nachádza v doméne efektora GTPázy (GED) na C-konci Drp1. Priama acylácia ktoréhokoľvek z týchto cysteínov by mohla spôsobiť poruchu aktivity v Drp1, a preto je základom účinku SFN na mitochondriálnu dynamiku. Predchádzajúca práca naznačuje, že defekty v oligomerizácii a katalytickej aktivite môžu zrušiť zadržiavanie Drp1 v mitochondriách [52]. Cys644 v doméne GED je obzvlášť atraktívnym cieľom na základe predchádzajúcej práce, ktorá ukazuje, že mutácia tohto cysteínového fenokopie spôsobuje mutácie, ktoré zhoršujú aktivitu Drp1 GTPázy [4] a že tento konkrétny cysteín je modifikovaný tiol-reaktívnymi elektrofilmi [9]. Vyriešenie tejto nevyriešenej otázky si bude vyžadovať hmotnostnú spektrometrickú validáciu. V súhrne sme identifikovali novú, cytoprotektívnu funkciu pre klinicky relevantnú zlúčeninu SFN. Okrem aktivácie hlavného antioxidačného transkripčného faktora Nrf2 SFN podporuje mitochondriálnu a peroxizomálnu fúziu a tento účinok je nezávislý od Nrf2. Mechanizmus, ktorý je základom tohto javu, zahŕňa zníženie funkcie GTPázy Drp1, primárneho mediátora mitochondriálneho a peroxizomálneho štiepenia. Hlavným dôsledkom mitochondriálnej fúzie sprostredkovanej SFN je, že bunky sa stávajú odolnými voči toxickým účinkom induktora apoptózy staurosporínu. Tento dodatočný cytoprotektívny účinok SFN by mohol byť obzvlášť klinicky užitočný pri mnohých neurodegeneratívnych ochoreniach, pre ktoré je vek hlavným rizikovým faktorom (napr. Parkinsonova choroba, Alzheimerova choroba, vekom podmienená makulárna degenerácia), keďže tieto choroby sa spájajú s apoptózou a znižujú hladiny a/alebo dysregulácia Nrf2 [35], [36], [48].
Materiály a metódy
Apoptózové testy
Bunky boli naočkované a transfekované siRNA, ako je uvedené nižšie. Bunky boli vopred ošetrené 50 uM sulforafanom počas 2 hodín, aby sa indukovala mitochondriálna fúzia, a potom boli ošetrené 1 uM staurosporínom, aby sa vyvolala apoptóza. V čase zberu sa médium zhromaždilo v jednotlivých skúmavkách a podrobilo sa vysokorýchlostnej centrifugácii, aby sa usadili apoptotické bunky. Táto bunková peleta bola spojená s adherentnými bunkami a solubilizovaná v 2-krát koncentrovanom Laemmliho pufri. Vzorky boli podrobené anti-PARP Western blotovaniu.
Generovanie konštruktov CRISPR/Cas9
Na vytvorenie LentiCRISPR/eCas9 1.1 bol LentiCRISPR v2 (prídavok #52961) najprv vyrezaný pomocou Age1 a BamH1. Ďalej bol SpCas9 z eSpCas9 1.1 (prídavok č. 71814) amplifikovaný pomocou PCR s presahmi Age1 a BamH1 s použitím nasledujúcich primérov (Forward AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, Reverse AAGCGCGGATTCCTGTTGTT vyššie) a ligovaný do vektora CCCGCTGTTGTT vyššie. Sekvencie sgRNA sa určili pomocou Benchling.com. Parametre boli nastavené tak, aby sa zamerali na kódujúcu sekvenciu s najvyšším cieľovým a najnižším skóre mimo cieľa. Nasledujúca sekvencia (určujúci sekvencia podčiarknuté, hs sgNFE2L2 # 1 zmysel CACCGCGACGGAAAGAGTATGAGC, antisencie AAACGCTCATACTCTTTCCGTCGC; hs sgNFE2L2 # 2 zmysel CACCGGTTTCTGACTGGATGTGCT, antisencie AAACAGCACATCCAGTCAGAAACC; HS sgNFE2L2 # 3 zmysel CACCGGAGTAGTTGGCAGATCCAC, antisencie AAACGTGGATCTGCCAACTACTCC) boli žíhané a ligován do BsmB1 rez LentiCRISPR / eCas9 1.1. Lentivírusovo infikované bunky RPE-1 boli selektované puromycínom a udržiavané ako spojená populácia. Knockout bol potvrdený imunofluorescenciou a westernovým prenosom.
Bunkové kultúry a transfekcie
Ľudské retinálne pigmentové epitelové bunky transformované telomerázou (RPE-1) (ATCC) boli kultivované v Dulbeccovom modifikovanom Eagle médiu (DMEM) obsahujúcom 1 g/l glukózy doplnenej penicilínom, streptomycínom, 1X kokteilom neesenciálnych aminokyselín (Life Technologies), a 10 % fetálneho bovinného séra (Life Technologies). Pre siRNA-transfekcie sa cez noc naočkovalo 30,000 35,000 - 10 0.3 buniek/ml. Bunky dostali 1 nM siRNA zriedenú v DMEM bez séra a kombinovanú s 2 % interferínovým transfekčným činidlom (PolyPlus). Na senzibilizáciu apoptózou bunky dostali 3 nM Bcl-XL siRNA. Bunky boli zozbierané XNUMX až XNUMX dni po transfekcii.
Chemikálie, protilátky a siRNA oligo
Protilátky proti ?-tubulínu (Cell Signaling), P-tubulínu (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) a Tom20 (BD Biosciences ) sa použili v riedeniach 1:1000 na western blot a na imunofluorescenciu. Vlastná králičia protilátka anti-Nrf2 bola použitá v pomere 1:2000 na Western blotting [34], [59]. Sulforaphane (Sigma) a staurosporín (Tocris) boli použité v koncentrácii 50 uM, respektíve 1 uM. siRNA proti Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (bunková signalizácia) a Bcl-XL (bunková signalizácia) sa použili pri 10 nM, pokiaľ nie je uvedené inak.
Imunofluorescencia a in vivo značenie
Bunky nasadené na 18 mm sklenené krycie sklíčka boli ošetrené vehikulom alebo liečivom, fixované v 3.7% formaldehyde a potom permeabilizované v 0.2% Triton X-100/PBS na ľade počas 10 minút. Primárne protilátky boli inkubované v 3% hovädzom sérovom albumíne (BSA) v PBS cez noc pri 4 °C. Po premytí PBS sa bunky inkubovali počas 1 hodiny v druhovo vhodných, Alexa488- alebo Alexa546-, konjugovaných sekundárnych protilátkach (zriedených 1:1000) a 0.1 ug/ml DAPI (Sigma) v 3 % BSA/PBS. Mitochondrie boli vizualizované buď imunofluorescenciou anti-Tom20 alebo inkubáciou buniek v 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) v DMEM bez séra počas 30 minút pri 37 °C pred fixáciou.
Mikroskopia a analýza obrazu
Imunofluorescenčné vzorky boli pozorované na konfokálnom mikroskope LSM710 (Carl Zeiss). Mikrofotografie boli zachytené pomocou objektívov s olejovou imerziou 63X alebo 100X a obrázky boli upravené a vylepšené pomocou Adobe Photoshop CS6. Analýza spoločnej lokalizácie sa uskutočnila pomocou funkcie spoločnej lokalizácie Carl Zeiss LSM710 s manuálne nastavenými prahovými hodnotami, pričom nebola zistená identita vzoriek. Mierka v celom rozsahu, pokiaľ nie je uvedené inak, je 10 �m. Mitochondriálna morfológia bola hodnotená slepým skórovaním. Ak boli mitochondrie bunky udržiavané ako viacnásobné, okrúhle, rozlišujúce bodky, bunka bola hodnotená ako „štiepenie“. Ak boli jednotlivé mitochondrie nerozoznateľné a celá mitochondriálna sieť sa zdala kontinuálna, bunka bola hodnotená ako „fúzia“. Všetky ostatné bunky, vrátane buniek s klastrovými mitochondriami, boli hodnotené ako „stredné“.
Subcelulárne frakcionácie
Bunky RPE-1 boli pestované do konfluencie. Po premytí PBS sa bunky podrobili centrifugácii pri 600 ug počas 10 minút a resuspendovali sa v 600 ul izolačného pufra (210 mM manitol, 70 mM sacharóza, 5 mM MOPS, 1 mM EDTA pH 7.4 + 1 mM PMSF). Suspenzia sa lýzovala 30-krát v homogenizátore Dounce. Frakcia homogenátu sa zachovala ako „lyzát celých buniek“. Zvyšok sa podrobil centrifugácii pri 800 ug počas 10 minút, aby sa peletovali jadrá. Supernatanty sa podrobili centrifugácii pri 1500 �g počas 10 minút, aby sa vyčistili zostávajúce jadrá a nelyzované bunky. Tento supernatant sa podrobil centrifugácii pri 15,000 15 �g počas XNUMX minút, aby sa peletovali mitochondrie. Supernatant sa zachoval ako „cytosolická frakcia“. Peleta bola jemne premytá PBS a resuspendovaná v izolačnom pufri. Koncentrácia proteínu každej frakcie sa merala testom s kyselinou bicinchonínovou (BCA) a ekvivalentné množstvá proteínu sa rozdelili pomocou SDS-PAGE.
Western Blotting
Bunky sa premyli v PBS a solubilizovali v 2-krát koncentrovanom Laemmliho solubilizačnom pufri (100 mM Tris [pH 6.8], 2 % SDS, 0.008 % brómfenolová modrá, 2 % 2-merkaptoetanol, 26.3 % glycerol a 0.001 % pyrinín Y). Lyzáty sa varili 5 minút pred nanesením na polyakrylamidové gély dodecylsulfátu sodného (SDS). Proteíny sa preniesli na nitrocelulózové membrány a membrány sa blokovali počas 1 hodiny v 5% mlieku/TBST. Primárne protilátky boli zriedené v 5% mlieku/TBST a inkubované s blotom cez noc pri 4 °C. Sekundárne protilátky konjugované s chrenovou peroxidázou (HRP) boli zriedené v 5% mlieku/TBST. Bloty boli spracované so zvýšenou chemiluminiscenciou a denzitometrické kvantifikácie boli uskutočnené pomocou softvéru ImageJ.

Sulforaphane je chemikália z izotiokyanátovej zbierky organosírových látok získaných z krížovej zeleniny vrátane brokolice, kapusty, karfiolu, kelu a kríčkov, medzi inými. Sulforafán vzniká, keď enzým myrozináza transformuje glukorafanín, glukozinolát, na sulforafan, tiež známy ako sulforafan-glukozinolát. Brokolicové klíčky a karfiol majú najvyššiu koncentráciu glukorafanínu alebo prekurzora sulforafanu. Výskumné štúdie preukázali, že sulforafan zvyšuje antioxidačné schopnosti ľudského tela pri prevencii rôznych zdravotných problémov. Dr. Alex Jimenez DC, CCST Insight
Sulforaphane a jeho účinky na rakovinu, úmrtnosť, starnutie, mozog a správanie, srdcové choroby a ďalšie
Izotiokyanáty sú niektoré z najdôležitejších rastlinných zlúčenín, ktoré môžete získať vo svojej strave. V tomto videu pre nich robím najkomplexnejší prípad, aký kedy bol vyrobený. Krátka doba pozornosti? Preskočte na svoju obľúbenú tému kliknutím na jeden z časových bodov nižšie. Úplná časová os nižšie.
Kľúčové sekcie:
- 00:01:14 – Rakovina a úmrtnosť
- 00:19:04 – Starnutie
- 00:26:30 – Mozog a správanie
- 00:38:06 – Záverečná rekapitulácia
- 00:40:27 – Dávka
Úplná časová os:
- 00:00:34 – Predstavenie sulforafanu, hlavné zameranie videa.
- 00:01:14 – Spotreba krížovej zeleniny a zníženie úmrtnosti zo všetkých príčin.
- 00:02:12 – Riziko rakoviny prostaty.
- 00:02:23 – Riziko rakoviny močového mechúra.
- 00:02:34 – Riziko rakoviny pľúc u fajčiarov.
- 00:02:48 – Riziko rakoviny prsníka.
- 00:03:13 – Hypotetické: čo ak už máte rakovinu? (intervenčné)
- 00:03:35 – Pravdepodobný mechanizmus, ktorý riadi asociatívne údaje o rakovine a úmrtnosti.
- 00:04:38 – Sulforafán a rakovina.
- 00:05:32 – Dôkazy na zvieratách ukazujúce silný účinok extraktu z výhonkov brokolice na vývoj nádoru močového mechúra u potkanov.
- 00:06:06 – Účinok priamej suplementácie sulforafanu u pacientov s rakovinou prostaty.
- 00:07:09 – Bioakumulácia izotiokyanátových metabolitov v aktuálnom prsnom tkanive.
- 00:08:32 – Inhibícia kmeňových buniek rakoviny prsníka.
- 00:08:53 – Lekcia dejepisu: Brassica bola preukázaná ako zdraviu prospešné už v starovekom Ríme.
- 00:09:16 – Schopnosť sulforafanu zvyšovať vylučovanie karcinogénov (benzén, akroleín).
- 00:09:51 – NRF2 ako genetický prepínač prostredníctvom prvkov antioxidačnej odozvy.
- 00:10:10 – Ako aktivácia NRF2 zvyšuje vylučovanie karcinogénu cez glutatión-S-konjugáty.
- 00:10:34 – Ružičkový kel zvyšuje glutatión-S-transferázu a znižuje poškodenie DNA.
- 00:11:20 – Nápoj z brokolicových klíčkov zvyšuje vylučovanie benzénu o 61 %.
- 00:13:31 – Homogenát brokolicových klíčkov zvyšuje antioxidačné enzýmy v horných dýchacích cestách.
- 00:15:45 – Spotreba krížovej zeleniny a úmrtnosť na srdcové choroby.
- 00:16:55 – Prášok z brokolicových klíčkov zlepšuje krvné lipidy a celkové riziko srdcových chorôb u diabetikov 2. typu.
- 00:19:04 – Začiatok úseku starnutia.
- 00:19:21 – Diéta obohatená o sulforafan zvyšuje životnosť chrobákov z 15 na 30 % (za určitých podmienok).
- 00:20:34 – Význam nízkeho zápalu pre dlhovekosť.
- 00:22:05 – Zdá sa, že krížová zelenina a prášok z brokolicových klíčkov znižujú množstvo zápalových markerov u ľudí.
- 00:23:40 – Rekapitulácia v polovici videa: rakovina, starnutie
- 00:24:14 – Štúdie na myšiach naznačujú, že sulforafan môže zlepšiť adaptívnu imunitnú funkciu v starobe.
- 00:25:18 – Sulforaphane zlepšil rast vlasov u myšieho modelu plešatenia. Snímka o 00:26:10.
- 00:26:30 – Začiatok sekcie mozog a správanie.
- 00:27:18 – Vplyv extraktu z brokolicových klíčkov na autizmus.
- 00:27:48 – Účinok glukorafanínu na schizofréniu.
- 00:28:17 – Začiatok diskusie o depresii (pravdepodobný mechanizmus a štúdie).
- 00:31:21 – Štúdia na myšiach s použitím 10 rôznych modelov depresie vyvolanej stresom ukazuje, že sulforafan je podobne účinný ako fluoxetín (prozac).
- 00:32:00 – Štúdia ukazuje, že priame požitie glukorafanínu u myší je podobne účinné pri prevencii depresie zo sociálneho modelu stresu.
- 00:33:01 – Začiatok sekcie neurodegenerácie.
- 00:33:30 – Sulforafán a Alzheimerova choroba.
- 00:33:44 – Sulforaphane a Parkinsonova choroba.
- 00:33:51 - Sulforaphane a Hungtingtonova choroba.
- 00:34:13 – Sulforaphane zvyšuje proteíny tepelného šoku.
- 00:34:43 – Začiatok sekcie traumatického poranenia mozgu.
- 00:35:01 – Sulforaphane podaný ihneď po TBI zlepšuje pamäť (štúdia na myšiach).
- 00:35:55 – Sulforafán a plasticita neurónov.
- 00:36:32 – Sulforaphane zlepšuje učenie v modeli diabetu typu II u myší.
- 00:37:19 – Sulforaphane a Duchennova svalová dystrofia.
- 00:37:44 – Inhibícia myostatínu vo svalových satelitných bunkách (in vitro).
- 00:38:06 – Neskoré video rekapitulácia: úmrtnosť a rakovina, poškodenie DNA, oxidačný stres a zápal, vylučovanie benzénu, kardiovaskulárne ochorenia, diabetes typu II, účinky na mozog (depresia, autizmus, schizofrénia, neurodegenerácia), dráha NRF2.
- 00:40:27 – Myšlienky na to, ako zistiť dávku brokolicových klíčkov alebo sulforafanu.
- 00:41:01 – Anekdoty o klíčení doma.
- 00:43:14 – O teplotách varenia a aktivite sulforafanu.
- 00:43:45 – Premena sulforafanu z glukorafanínu črevnými baktériami.
- 00:44:24 – Doplnky fungujú lepšie v kombinácii s aktívnou myrozinázou zo zeleniny.
- 00:44:56 – Techniky varenia a krížová zelenina.
- 00:46:06 – Izotiokyanáty ako struma.
Poďakovanie
Sciencedirect.com/science/article/pii/S2213231716302750
Ako sa vyrába Sulforaphane?
Zahrievanie znižuje aktivitu proteínu epitiospecifikátora a zvyšuje tvorbu sulforafanu v brokolici
abstraktné
Sulforaphane, izotiokyanát z brokolice, je jedným z najsilnejších antikarcinogénov pochádzajúcich z potravín. Táto zlúčenina sa v neporušenej zelenine nevyskytuje, ale vzniká z jej glukozinolátového prekurzora, glukorafanínu, pôsobením myrozinázy, enzýmu tioglukozidázy, pri drvení alebo žuvaní tkaniva brokolice. Množstvo štúdií však preukázalo, že výťažok sulforafanu z glukorafanínu je nízky a že nebioaktívny nitrilový analóg, nitril sulforafanu, je primárnym produktom hydrolýzy, keď sa rastlinné tkanivo rozdrví pri teplote miestnosti. Nedávne dôkazy naznačujú, že v Arabidopsis je tvorba nitrilu z glukozinolátov riadená proteínom citlivým na teplo, epitiošpecifikačným proteínom (ESP), nekatalytickým kofaktorom myrozinázy. Naším cieľom bolo preskúmať účinky zahrievania ružičiek a klíčkov brokolice na tvorbu sulforafanu a sulforafannitrilu, určiť, či brokolica obsahuje aktivitu ESP, potom korelovať zmeny v aktivite ESP, obsahu sulforafanu a bioaktivite, ktoré sú závislé od tepla, merané indukciou detoxikačný enzým fázy II chinónreduktáza (QR) v bunkovej kultúre. Zahriatie čerstvých ružičiek brokolice alebo brokolicových klíčkov na 60 °C pred homogenizáciou súčasne zvýšilo tvorbu sulforafanu a znížilo tvorbu nitrilu sulforafanu. Významná strata aktivity ESP bola paralelná s poklesom tvorby sulforafannitrilu. Zahriatie na 70 �C a vyššie znížilo tvorbu oboch produktov v ružičkách brokolice, ale nie v klíčkoch brokolice. Indukcia QR v kultivovaných bunkách myšacieho hepatómu Hepa lclc7 paralelne so zvýšením tvorby sulforafanu.

Predhriatie ružičiek a klíčkov brokolice na 60 °C výrazne zvýšilo myrozinázou katalyzovanú tvorbu sulforafanu (SF) v extraktoch rastlinného tkaniva po rozdrvení. Súviselo to so znížením tvorby nitrilu sulforafanu (SF nitril) a aktivity epitiošpecifikačného proteínu (ESP).
Kľúčové slová: Brokolica, Brassica oleracea, Cruciferae, Rakovina, Antikarcinogén, Sulforaphane, Sulforaphane nitril, Epitiospecifier proteín, Chinonreduktáza
Na záver, sulforafan je fytochemikália nachádzajúca sa v brokolici a inej krížovej zelenine. Nekontrolované množstvo oxidantov spôsobené vnútornými aj vonkajšími faktormi môže v ľudskom tele spôsobiť oxidačný stres, ktorý môže v konečnom dôsledku viesť k rôznym zdravotným problémom. Sulforaphane môže aktivovať produkciu Nrf2, transkripčného faktora, ktorý pomáha regulovať ochranné antioxidačné mechanizmy, ktoré riadia odpoveď buniek na oxidanty. Rozsah našich informácií je obmedzený na chiropraktické a zdravotné problémy chrbtice. Ak chcete prediskutovať túto tému, neváhajte sa opýtať Dr. Jimeneza alebo nás kontaktujte na adrese�915-850-0900 .
Kurátorom je Dr. Alex Jimenez
Odkazované z: Sciencedirect.com

Ďalšia téma diskusie:�Akútna bolesť chrbta
Bolesti chrbta�je jednou z najčastejších príčin invalidity a vymeškaných dní v práci na celom svete. Bolesti chrbta sú druhým najčastejším dôvodom návštevy lekára, prevyšujú ho iba infekcie horných dýchacích ciest. Približne 80 percent populácie aspoň raz za život zažije bolesť chrbta. Chrbtica je komplexná štruktúra pozostávajúca z kostí, kĺbov, väzov a svalov, okrem iných mäkkých tkanív. Z tohto dôvodu môžu zranenia a/alebo zhoršené stavy, ako naprherné disky, môže nakoniec viesť k príznakom bolesti chrbta. Športové zranenia alebo zranenia pri automobilových nehodách sú často najčastejšou príčinou bolesti chrbta, niekedy však môžu mať aj tie najjednoduchšie pohyby bolestivé následky. Našťastie alternatívne možnosti liečby, ako je chiropraktická starostlivosť, môžu pomôcť zmierniť bolesť chrbta pomocou úprav chrbtice a manuálnych manipulácií, čo v konečnom dôsledku zlepšuje úľavu od bolesti.

EXTRA EXTRA | DÔLEŽITÁ TÉMA: Odporúčaný El Paso, TX Chiropraktik
***
Informácie tu uvedené o „Čo je Sulforaphane?" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka






