1. KTO. KTO | Nadváha a obezita. www.who.int/gho/ncd/
risk_factors/overweight/en/index.html. Prístupné 29. januára 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Päť rokov objavu GWAS.
Am J Hum Genet. 2012; 90:7�24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, et al. Genetické
štúdie indexu telesnej hmotnosti prinášajú nové poznatky pre biológiu obezity. Príroda.
2015;518:197�206.
4. Ling C, Del Guerra S, Lupi R, R.nn T, Granhall C, Luthman H, a kol.
Epigenetická regulácia PPARGC1A v ľudských diabetických ostrovčekoch typu 2 a
vplyv na sekréciu inzulínu. Diabetológia. 2008;51:615�22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Epigenetika
a ľudská obezita. Int J Obes (Londýn). 2015;39:85�97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J a kol. Účinok
genotypu a in utero prostredí na interindividuálnu variáciu u novorodenca
DNA metylómy. Genome Res. 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA a kol. Genomewide
asociácie medzi vplyvom genetickej a epigenetickej variácie
Expresia mRNA a sekrécia inzulínu v ľudských pankreatických ostrovčekoch. PLoS
Genet. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A a kol.
Globálna analýza variácií metylácie DNA v tukovom tkanive z dvojčiat
odhaľuje väzby na varianty spojené s ochorením v distálnych regulačných prvkoch.
Am J Hum Genet. 2013; 93:876�90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Vplyv veku, BMI a hladín HbA1c na DNA celého genómu
metylácia a vzory expresie mRNA v ľudskom tukovom tkanive
a identifikácia epigenetických biomarkerov v krvi. Hum Mol Genet.
2015;24:3792�813.
10. Waterland RA, Michels KB. Epigenetická epidemiológia vývinu
hypotéza pôvodu. Annu Rev Nutr. 2007;27:363�88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, a kol. Skoré počiatky neskoršej obezity: cesty a mechanizmy. Adv
Exp Med Biol. 2009;646:71�81.
12. Ravelli A, van der Meulen J, Michels R., Osmond C., Barker D., Hales C. a kol.
Glukózová tolerancia u dospelých po prenatálnej expozícii hladomoru. Lancet.
1998;351:173�7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Vývojový pôvod zdravia a choroby dospelých: úloha
perikoncepčná a fetálna výživa. Basic Clin Pharmacol Toxicol.
2008;102:82�9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Perikoncepčné
výživy a včasného naprogramovania života s obezitou alebo nepriazňou osudu. Prog
Biophys Mol Biol. 2011;106:307�14.
15. Bouret S, Levin BE, Ozanne SE. Riadenie interakcií medzi génmi a prostredím
energetická a glukózová homeostáza a vývojový pôvod obezity.
Physiol Rev. 2015;95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM a kol.
Obezita matiek zvyšuje diferenciáciu bieleho tukového tkaniva a mení sa
metylácia DNA na úrovni genómu u potomkov samcov potkanov. Endokrinológia.
2013;154:4113�25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
a kol. Metabolická plasticita počas vývoja cicavcov je smerovaná
v závislosti od skorého stavu výživy. Proc Natl Acad Sci USA A.
2007;104:12796�800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
a kol. Metylácia promótora epigenetického génu pri narodení je spojená s
neskoršia adipozita dieťaťa. Diabetes. 2011;60:1528�34.
19. McMillen IC, Adam CL, Muhlhausler BS. Počiatky obezity:
programovanie regulačného systému chuti do jedla. J Physiol. 2005;565(Pt 1):9�17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F a kol.
Epigenetické zmeny v dráhach regulácie energie hypotalamu plodu sú
spojené s podvýživou matiek a twinningom. FASEB J.
2012;26:1694�703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY a kol. Materská obezita
a diabetes môže spôsobiť zmenu metylácie DNA v spermiách
potomstvo u myší. Reprod Biol Endocrinol. 2014;12:29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A a kol.
Perinatálna podvýživa ovplyvňuje metyláciu a expresiu leptínu
gén u dospelých: implikácia pre pochopenie metabolického syndrómu.
FASEB J. 2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F a kol.
Materská strava počas tehotenstva indukuje génovú expresiu a DNA
metylačné zmeny v tkanivách plodu u oviec. Predná Genet. 2013;4:49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, et al.
Materská obezita a diabetes vyvoláva latentné metabolické defekty a
rozsiahle epigenetické zmeny u izogénnych myší. Epigenetika. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Diétny proteín
obmedzenie gravidných potkanov vyvoláva a suplementácia kyseliny listovej zabraňuje
epigenetická modifikácia expresie pečeňových génov u potomstva. J Nutr.
2005;135:1382�6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. V maternici
účinky. In utero podvýživa narúša metylóm dospelých spermií
a medzigeneračný metabolizmus. Veda. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R a kol.
Epigenomika: vystavenie materskej strave s vysokým obsahom tukov in utero narúša
periférna cirkadiánna génová expresia u primátov (okrem človeka). FASEB J.
2011;25:714�26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA a kol. V maternici
vystavenie materskej strave s vysokým obsahom tukov mení epigenetický histónový kód v a
myšací model. Am J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG a kol.
Epigenetika programovanej obezity: zmena IUGR potkanieho pečeňového IGF1
expresia mRNA a štruktúra histónov v rýchlom verzus oneskorenom postnatálnom období
dobiehajúci rast. Am J Physiol Gastrointest Pečeň Physiol.
2010;299:G1023�9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
a kol. Materská strava a starnutie menia epigenetickú kontrolu promótora
interakcie na géne Hnf4a v pankreatických ostrovčekoch potkanov. Proc Natl
Acad Sci USA A. 2011;108:5449�54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Vyšetrovania na
transgeneračnú epigenetickú odpoveď po samčej línii u ošípaných F2. PLoS
Jeden. 2012;7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R a kol. Otcovsky
indukované transgeneračné environmentálne preprogramovanie metabolických
génová expresia u cicavcov. Bunka. 2010;143:1084�96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. Diéta otcov
definuje chromatínový stav potomstva a medzigeneračnú obezitu. Bunka.
2014;159:1352�64.
34. Mart�nez D, Pentinat T, Rib� S, Daviaud C, Bloks VW, Cebri� J, et al. V maternici
podvýživa u samcov myší programuje metabolizmus pečeňových lipidov v druhej generácii
potomstvo zahŕňajúce zmenenú metyláciu DNA Lxra. Cell Metab.
2014;19:941�51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H a kol. Otcovsky
indukovanej transgeneračnej dedičnosti náchylnosti na diabetes v
cicavcov. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Transgeneračná epigenetická dedičnosť: aká dôležitá je? Nat Rev
Genet. 2013;14:228�35.
37. Pembrey M, Saffery R, Bygren LO. Ľudské transgeneračné reakcie na
skúsenosti z raného veku: potenciálny vplyv na rozvoj, zdravie a
biomedicínsky výskum. J Med Genet. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Materská epigenetika a metyl
doplnky ovplyvňujú expresiu génu agouti u myší Avy/a. FASEB J.
1998;12:949�57.
39. Jirtle RL, Skinner MK. Environmentálna epigenomika a náchylnosť k chorobám.
Nat Rev Genet. 2007;8:253�62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Epigenetická dedičnosť v
lokus agouti v myši. Nat Genet. 1999;23:314�8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Epigenetická zárodočná línia
modifikácia myšacej alely A vy výživovým doplnkom. Proc
Natl Acad Sci USA 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Diétny proteín
obmedzenie počas F0 gravidity u potkanov vyvoláva transgeneračné zmeny v
pečeňový transkriptóm u samičieho potomstva. PLoS One. 2011;6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P a kol. Myší človek
experimentálna epigenetická analýza odhaľuje diétne ciele a
genetická zodpovednosť za diabetické fenotypy. Cell Metab. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I a kol.
Odporúčania pre návrh a analýzu celého epigenómu
asociačné štúdie. Metódy Nat. 2013;10:949�55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R�nn T, Ling C. Identifikácia
CpG-SNP spojené s diabetom typu 2 a diferenciálnou metyláciou DNA
v ľudských pankreatických ostrovčekoch. Diabetológia. 2013;56:1036�46.
46. Relton CL, Davey Smith G. Dvojstupňová epigenetická Mendelova randomizácia: a
stratégia na stanovenie kauzálnej úlohy epigenetických procesov v dráhach
k chorobe. Int J Epidemiol. 2012;41:161�76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
Údaje o asociácii celého epigenómu implikujú metyláciu DNA ako an
sprostredkovateľ genetického rizika pri reumatoidnej artritíde. Nat Biotechnol.
2013;31:142�7.
48. Yuan W, Xia Y, Bell CG, Yet I, Ferreira T, Ward KJ a kol. Integrovaný
epigenomická analýza lokusov náchylnosti na diabetes typu 2 u monozygotov
dvojčatá. Nat Commun. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Vplyv an
cvičebný zásah na metyláciu DNA v kostrovom svale od prvého stupňa
príbuzní pacientov s cukrovkou 2. typu. Diabetes. 2012;61:3322�32.
50. Gagnon F, A�ssi D, Carri� A, Morange PE, Tr�gou�t DA. Robustné overenie
asociácia hladín metylácie na lokuse CPT1A s hladinami lipidov v plazme.
J Lipid Res. 2014;55:1189�91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
a kol. Epigenómová asociačná štúdia (EWAS) BMI, zmena BMI a
obvod pása u dospelých Afroameričanov identifikuje viacnásobné replikácie
loci. Hum Mol Genet. 2015: ddv161�.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, A�ssi D, Wahl S, a kol. DNA
metylácia a index telesnej hmotnosti: analýza celého genómu. Lancet.
2014;6736:1�9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G a kol. metylácia DNA
gén LY86 je spojený s obezitou, inzulínovou rezistenciou a
zápal. Twin Res Hum Genet. 2014;17:183�91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, a kol.
PGC1? metylácia promótora v krvi vo veku 5 až 7 rokov predpovedá adipozitu z
9 až 14 rokov (EarlyBird 50). Diabetes. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L a kol.
Metylácia DNA promótora génu ADRB3 v krvi a viscerálnom tukovom tkanive
tkaniva je spojená s metabolickými poruchami u mužov. Epigenomika.
2014;6:33�43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Adipozita je
spojené s profilom metylácie DNA v tukovom tkanive. Int J Epidemiol.
2014: 1.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, a kol.
Epigenómová asociačná štúdia krvných lipidov nalačno v genetike o
Štúdia siete liekov na zníženie lipidov a diéty. Obeh. 2014;130:565�72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY a kol.
Metylácia na lokuse CPT1A je spojená s lipoproteínovou subfrakciou
profilov. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, a kol. DNA
metylácia génov súvisiacich s lipidmi ovplyvňuje hladiny lipidov v krvi. Circ Cardiovasc
Genet. 2015.
60. Petersen AK, Zeilinger S, Kastenm�ller G, R�misch-Margl W, Brugger M, Peters
A, a kol. Epigenetika sa stretáva s metabolomikou: asociácia týkajúca sa celého epigenómu
štúdia s metabolickými znakmi krvného séra. Hum Mol Genet. 2014;23:534�45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D a kol. Epigenomewide
asociačná štúdia meraní glukózy, inzulínu a HOMA-IR nalačno
v genetike liekov na zníženie lipidov a štúdiu diétnej siete. Diabetes.
2014;63:801�7.
62. Dayeh T, Volkov P, Sal� S, Hall E, Nilsson E, Olsson AH a kol. V celom genóme
Analýza metylácie DNA ľudských pankreatických ostrovčekov od diabetika 2
a nediabetických darcov identifikuje kandidátske gény, ktoré ovplyvňujú inzulín
sekrétu. PLoS Genet. 2014;10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK a kol.
Zmenená metylácia DNA a ovplyvnenie diferenciálnej expresie génov
metabolizmus a zápal v tukovom tkanive od jedincov s typom 2
cukrovka. Diabetes. 2014;63:2962�76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA a kol. Analýza metylácie DNA v ľudskom tukovom tkanive odhaľuje rozdielnu modifikáciu génov obezity pred a po bypasse žalúdka a hmotnosti
stratu. Gene. 2015;16:1�21.
65. Bateson P, Gluckman P. Plasticita a robustnosť vo vývoji a
evolúcia. Int J Epidemiol. 2012;41:219�23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolúcia v zdraví a
medicína Sacklerovo kolokvium: stochastická epigenetická variácia ako hnací motor
vývojová sila, evolučná adaptácia a choroba. Proc Natl Acad
Sci US A. 2010;107(Suppl):1757�64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R a kol.
Pozdĺžna analýza metylácie DNA na úrovni genómu u dvojčiat od narodenia
do 18 mesiacov veku odhaľuje rýchle epigenetické zmeny v ranom veku a párovo špecifické
účinky nesúladu. Genome Biol. 2013;14:R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y a kol. DNA
metylačné znaky spájajú prenatálnu expozíciu hladomoru s rastom a
metabolizmus. Nat Commun. 2014;5:5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA a kol.
Výživa matky pri počatí moduluje metyláciu DNA človeka
metastabilné epialely. Nat Commun. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L a kol.
Vplyv na vzorce metylácie potomkov gestačného diabetu matky
mellitus a vnútromaternicové obmedzenie rastu naznačujú spoločné gény a
cesty spojené s následným rizikom cukrovky 2. typu. FASEB J. 2014: 1�12.
71. Morales E, ženích A, Lawlor DA, Relton CL. Podpisy metylácie DNA v
pupočníková krv spojená s gestačným prírastkom hmotnosti matky: výsledky z
kohorta ALSPAC. BMC Res Notes. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP a kol.
Gestačný diabetes mellitus epigeneticky ovplyvňuje predovšetkým gény
podieľa sa na metabolických ochoreniach. Epigenetika. 2013;8:935�43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y a kol. Materská
prekoncepčný index telesnej hmotnosti a DNA pupočníkovej krvi potomstva
metylácia: skúmanie raného pôvodu chorôb. Environ Mol
Mutagén. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF a kol.
Novorodenci obéznych rodičov majú zmenené vzorce metylácie DNA pri
vtlačené gény. Int J Obes (Londýn). 2015;39:650�7.
75. Jacobsen SC, Br�ns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, a kol.
Účinky krátkodobého prekrmovania vysokým obsahom tuku na DNA v celom genóme
metylácia v kostrovom svale zdravých mladých mužov. Diabetológia.
2012;55:3341�9.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. PPARGC1A DNA
metylácia v podkožnom tukovom tkanive u jedincov s nízkou pôrodnou hmotnosťou�
vplyv 5 dní prekrmovania vysokým obsahom tuku. Metabolizmus. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Epigenetické vzorce u úspešných udržiavateľov chudnutia: pilotná štúdia. Int J
Obes (Londýn). 2015;39:865�8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N�slund E,
Zierath JR. Strata hmotnosti po operácii žalúdočného bypassu pri ľudskej obezite
remodeluje metyláciu promótora. Cell Rep. 2013: 1�8.
79. Ahrens M, Ammerpohl O, von Schönfels W, Kolarova J, Bens S, Itzel T, et al.
Analýza metylácie DNA pri nealkoholickom stukovatení pečene naznačuje
zreteľné znaky špecifické pre ochorenie a prestavbu po bariatrickej chirurgii.
Cell Metab. 2013;18:296�302.
80. Voisin S, Eynon N, Yan X, Bishop DJ. Cvičenie a metylácia DNA
u ľudí. Acta Physiol (Oxf). 2014;213:39�59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekstr�m TJ,
Tegn�r J, a kol. Integratívna analýza odhaľuje koordinované preprogramovanie
epigenómu a transkriptómu v ľudskom kostrovom svale po
školenia. Epigenetika. 2014;9:1557�69.
82. Denham J, O�Brien BJ, Marques FZ, Charchar FJ. Zmeny v leukocytoch
metylóm a jeho vplyv na kardiovaskulárne gény po cvičení.
J Appl Physiol. 2014:jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I a kol.
Multi-omické integrované siete spájajú metyláciu DNA a miRNA
plasticity kostrového svalstva až po chronické cvičenie pri diabetickej obezite 2. typu.
Physiol Genomics. 2014;46:747�65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
a kol. Obezita urýchľuje epigenetické starnutie ľudskej pečene. Proc Natl Acad
Sci. 2014;111:15538�43.
85. Alm�n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
Analýza v celom genóme odhaľuje markery metylácie DNA, ktoré sa líšia
vek aj obezita. Gene. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Bezreferenčné úpravy zmesi buniek
pri analýze údajov o metylácii DNA. Bioinformatika. 2014;30:1431�9.
87. Wells JC. Kritické posúdenie hypotézy prediktívnej adaptívnej odpovede.
Int J Epidemiol. 2012;41:229�35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, a kol. Počet embryí a perikoncepčná podvýživa v
ovce majú rozdielne účinky na adrenálny epigenotyp, rast a
rozvoj. Am J Physiol Endocrinol Metab. 2014;307:E141�50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Obezita matiek a raný pôvod detskej obezity: váženie
výhody a náklady na chudnutie matky v perikoncepcii
obdobie pre potomkov. Exp Diabetes Res. 2011;2011:585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, a kol. Podvýživa matky počas prvého týždňa po počatí
vedie k zníženej expresii mRNA glukokortikoidného receptora v
absencia hypermetylácie GR exónu 17 v hypofýze plodu v neskor
tehotenstva. J Dev Orig Heal Dis. 2013;4:391�401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
a kol. Perikoncepčné programy podvýživy zmeny v inzulínovej signalizácii
molekuly a mikroRNA v kostrovom svale u plodu s jedným plodom a dvojčaťom
ovce. Biol Reprod. 2014;90:5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ a kol. Aktivácia X receptora fetálnej pečene akútne indukuje lipogenézu, ale
neovplyvňuje odpoveď plazmatických lipidov na diétu s vysokým obsahom tukov u dospelých myší. Am J
Physiol Endocrinol Metab. 2009;297:E1171�8.
93. Fernandez-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, a kol. Zníženie regulácie IRS-1 in
tukové tkanivo potomkov obéznych myší je naprogramované bunkovoautonómne
prostredníctvom posttranskripčných mechanizmov. Mol Metab.
2014;3:325�33.
94. Waterland RA, Travisano M, Tahiliani KG. Diétou vyvolaná hypermetylácia at
aguti životaschopná žltá sa nededí transgeneračne cez samicu.
FASEB J. 2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC a kol. Metylácia DNA v
oocyty a pečeň samíc myší a ich potomkov: účinky vysokotukovej diéty
obezita. Env Heal Perspect. 2014;122:159�64.
96. Ollikainen M, Ismail K, Gervin K, Kyll�nen A, Hakkarainen A, Lundbom J, et al.
Zmeny metylácie DNA krvi v celom genóme na regulačných prvkoch
a heterochromatické oblasti u monozygotných dvojčiat nesúladné pre obezitu
a pečeňový tuk. Clin Epigenetics. 2015;7:1�13.








 Obezita je komplexné, multifaktoriálne ochorenie a lepšie pochopenie mechanizmov, ktoré sú základom interakcií medzi životným štýlom, prostredím a genetikou, je rozhodujúce pre vývoj účinných stratégií prevencie a liečby [1].
Obezita je komplexné, multifaktoriálne ochorenie a lepšie pochopenie mechanizmov, ktoré sú základom interakcií medzi životným štýlom, prostredím a genetikou, je rozhodujúce pre vývoj účinných stratégií prevencie a liečby [1]. Zvieracie modely poskytujú jedinečné príležitosti pre vysoko kontrolované štúdie, ktoré poskytujú mechanický pohľad na úlohu špecifických epigenetických znakov, a to ako indikátorov súčasného metabolického stavu, tak aj ako prediktorov budúceho rizika obezity a metabolických ochorení. Obzvlášť dôležitým aspektom štúdií na zvieratách je, že umožňujú hodnotenie epigenetických zmien v cieľových tkanivách, vrátane pečene a hypotalamu, čo je u ľudí oveľa ťažšie. Okrem toho schopnosť zozbierať veľké množstvá čerstvého tkaniva umožňuje posúdiť viaceré chromatínové značky, ako aj metyláciu DNA. Niektoré z týchto epigenetických modifikácií buď samotné alebo v kombinácii, môžu reagovať na environmentálne programovanie. Na zvieracích modeloch je možné študovať aj viac generácií potomkov a umožniť tak odlíšenie medzi transgeneračným a medzigeneračným prenosom rizika obezity sprostredkovaným epigenetickou pamäťou nutričného stavu rodičov, ktoré sa v štúdiách na ľuďoch nedajú ľahko rozlíšiť. Prvý termín používame pre meiotický prenos rizika v neprítomnosti pokračujúcej expozície, zatiaľ čo druhý znamená predovšetkým priamy prenos rizika prostredníctvom metabolického preprogramovania plodu alebo gamét.
Zvieracie modely poskytujú jedinečné príležitosti pre vysoko kontrolované štúdie, ktoré poskytujú mechanický pohľad na úlohu špecifických epigenetických znakov, a to ako indikátorov súčasného metabolického stavu, tak aj ako prediktorov budúceho rizika obezity a metabolických ochorení. Obzvlášť dôležitým aspektom štúdií na zvieratách je, že umožňujú hodnotenie epigenetických zmien v cieľových tkanivách, vrátane pečene a hypotalamu, čo je u ľudí oveľa ťažšie. Okrem toho schopnosť zozbierať veľké množstvá čerstvého tkaniva umožňuje posúdiť viaceré chromatínové značky, ako aj metyláciu DNA. Niektoré z týchto epigenetických modifikácií buď samotné alebo v kombinácii, môžu reagovať na environmentálne programovanie. Na zvieracích modeloch je možné študovať aj viac generácií potomkov a umožniť tak odlíšenie medzi transgeneračným a medzigeneračným prenosom rizika obezity sprostredkovaným epigenetickou pamäťou nutričného stavu rodičov, ktoré sa v štúdiách na ľuďoch nedajú ľahko rozlíšiť. Prvý termín používame pre meiotický prenos rizika v neprítomnosti pokračujúcej expozície, zatiaľ čo druhý znamená predovšetkým priamy prenos rizika prostredníctvom metabolického preprogramovania plodu alebo gamét.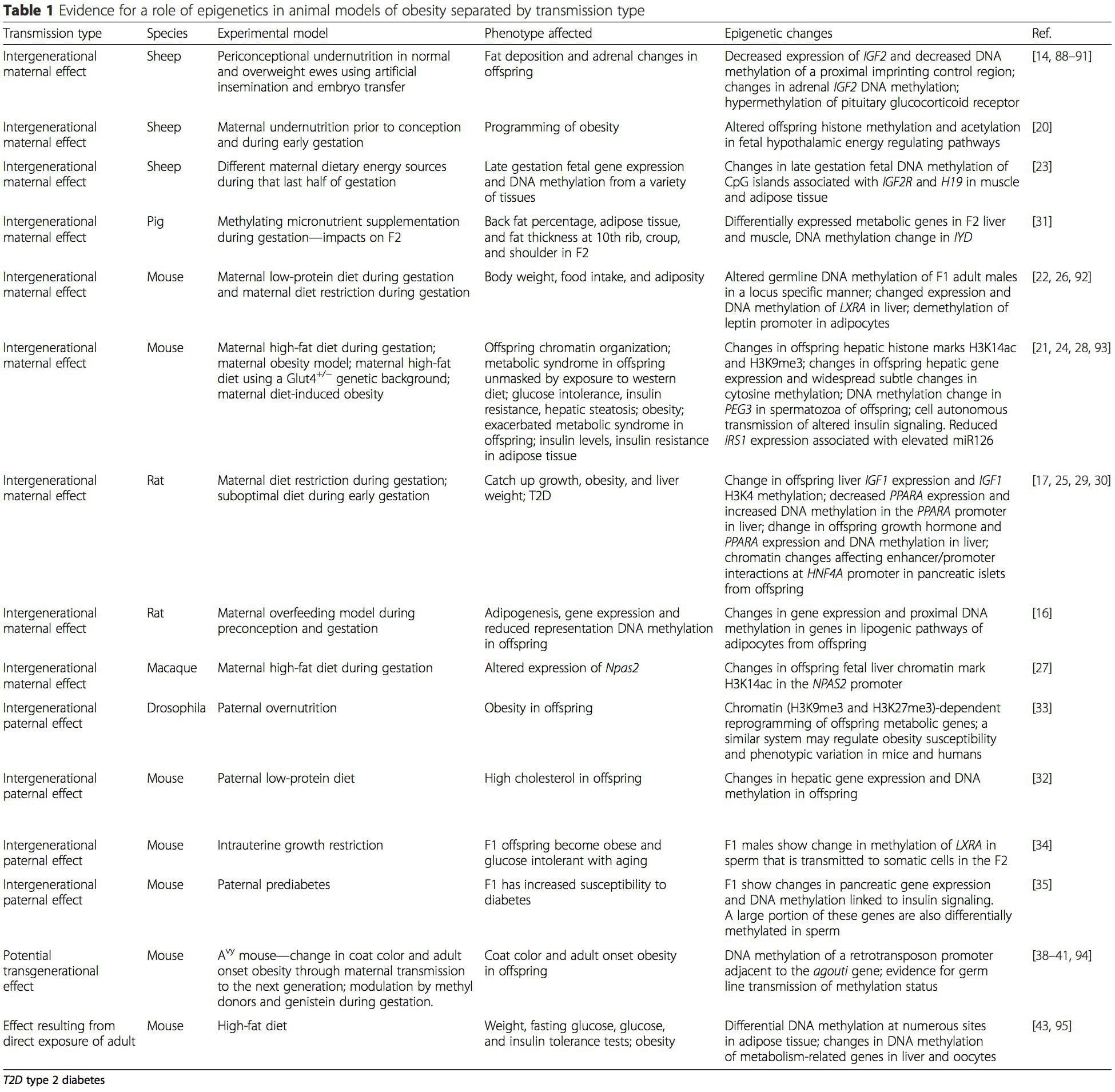 (i) Epigenetické zmeny u potomstva spojené s výživou matky počas tehotenstva
(i) Epigenetické zmeny u potomstva spojené s výživou matky počas tehotenstva Výživové doplnky matky, podvýživa a nadmerná výživa počas tehotenstva môžu zmeniť ukladanie tuku a energetickú homeostázu u potomstva [11, 13�15, 19]. S týmito účinkami u potomstva sú spojené zmeny v metylácii DNA, posttranslačné modifikácie histónov a génová expresia pre niekoľko cieľových génov, najmä génov regulujúcich metabolizmus mastných kyselín a inzulínovú signalizáciu [16, 17, 20 - 30]. Rozmanitosť zvieracích modelov použitých v týchto štúdiách a ovplyvnené bežné metabolické dráhy naznačujú evolučne konzervovanú adaptívnu reakciu sprostredkovanú epigenetickou modifikáciou. Avšak niekoľko špecifických identifikovaných génov a epigenetických zmien bolo krížovo overených v súvisiacich štúdiách a rozsiahle výskumy v rámci celého genómu sa zvyčajne neuplatňovali. Hlavnou prekážkou porovnania týchto štúdií sú rôzne vývojové mentálne okná vystavené nutričným výzvam, ktoré môžu spôsobiť značne odlišné výsledky. Vyžaduje sa tiež dôkaz, že epigenetické zmeny sú skôr kauzálne než spojené s fenotypovými zmenami potomstva. To si vyžiada identifikáciu rodičovskej nutrične indukovanej epigenetickej �pamäťovej� odpovede, ktorá predchádza vývoju zmeneného fenotypu u potomstva.
Výživové doplnky matky, podvýživa a nadmerná výživa počas tehotenstva môžu zmeniť ukladanie tuku a energetickú homeostázu u potomstva [11, 13�15, 19]. S týmito účinkami u potomstva sú spojené zmeny v metylácii DNA, posttranslačné modifikácie histónov a génová expresia pre niekoľko cieľových génov, najmä génov regulujúcich metabolizmus mastných kyselín a inzulínovú signalizáciu [16, 17, 20 - 30]. Rozmanitosť zvieracích modelov použitých v týchto štúdiách a ovplyvnené bežné metabolické dráhy naznačujú evolučne konzervovanú adaptívnu reakciu sprostredkovanú epigenetickou modifikáciou. Avšak niekoľko špecifických identifikovaných génov a epigenetických zmien bolo krížovo overených v súvisiacich štúdiách a rozsiahle výskumy v rámci celého genómu sa zvyčajne neuplatňovali. Hlavnou prekážkou porovnania týchto štúdií sú rôzne vývojové mentálne okná vystavené nutričným výzvam, ktoré môžu spôsobiť značne odlišné výsledky. Vyžaduje sa tiež dôkaz, že epigenetické zmeny sú skôr kauzálne než spojené s fenotypovými zmenami potomstva. To si vyžiada identifikáciu rodičovskej nutrične indukovanej epigenetickej �pamäťovej� odpovede, ktorá predchádza vývoju zmeneného fenotypu u potomstva. Nové štúdie ukázali, že otcovská úroveň výživy môže ovplyvniť ukladanie tuku u potomkov a epigenetické znaky [31�34]. Jeden nedávny výskum na myšiach ukázal, že prediabetes u otca vedie k zvýšenej náchylnosti na diabetes u F1 potomkov so súvisiacimi zmenami v expresii génov pankreasu a metylácii DNA spojenej s inzulínovou signalizáciou [35]. Dôležité je, že došlo k prekrývaniu týchto epigenetických zmien v pankreatických ostrovčekoch a spermiách, čo naznačuje dedičnosť zárodočnej línie. Avšak väčšina z týchto štúdií, aj keď je zaujímavá vo svojich dôsledkoch, je obmedzená v genómovej škále skúmania a často vykazuje slabé a trochu prechodné epigenetické zmeny spojené s miernymi metabolickými fenotypmi u potomkov.
Nové štúdie ukázali, že otcovská úroveň výživy môže ovplyvniť ukladanie tuku u potomkov a epigenetické znaky [31�34]. Jeden nedávny výskum na myšiach ukázal, že prediabetes u otca vedie k zvýšenej náchylnosti na diabetes u F1 potomkov so súvisiacimi zmenami v expresii génov pankreasu a metylácii DNA spojenej s inzulínovou signalizáciou [35]. Dôležité je, že došlo k prekrývaniu týchto epigenetických zmien v pankreatických ostrovčekoch a spermiách, čo naznačuje dedičnosť zárodočnej línie. Avšak väčšina z týchto štúdií, aj keď je zaujímavá vo svojich dôsledkoch, je obmedzená v genómovej škále skúmania a často vykazuje slabé a trochu prechodné epigenetické zmeny spojené s miernymi metabolickými fenotypmi u potomkov.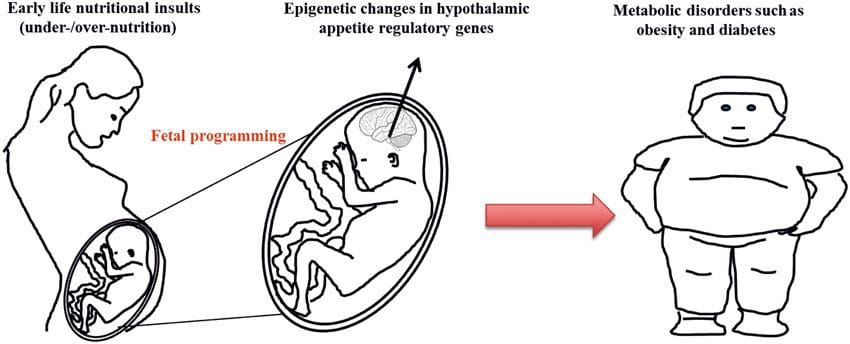 Stabilný prenos epigenetických informácií naprieč viacerými generáciami je dobre opísaný v rastlinných systémoch a C. elegánov, ale o jeho význame u cicavcov sa stále veľa diskutuje [36, 37]. Epigenetický základ pre prenos fenotypov starými rodičmi v reakcii na expozíciu v strave je dobre známy, a to aj u druhov hospodárskych zvierat [31]. Najvplyvnejšie štúdie demonštrujúce účinky epigenetického prenosu ovplyvňujúceho fenotyp potomstva použili príklad životaschopnej žltej myši aguti (Avy) [38]. U tejto myši inzercia retrotranspozónu upstream od génu agouti spôsobuje jeho konštitutívnu expresiu a následnú žltú farbu srsti a nástup obezity u dospelých. Materský prenos cez zárodočnú líniu vedie k umlčaniu expresie agouti sprostredkovanej metyláciou DNA, čo vedie k farbe srsti divokého typu a chudému fenotypu potomstva [39, 40]. Dôležité je, že následné štúdie na týchto myšiach ukázali, že vystavenie matiek donorom metylu spôsobuje zmenu farby srsti [41]. Jedna štúdia uvádza prenos fenotypu do generácie F3 a zmeny v expresii veľkého počtu génov v reakcii na obmedzenie proteínov vo F0 [42]; avšak zmeny v expresii boli veľmi variabilné a v tomto systéme nebola identifikovaná priama súvislosť s epigenetickými zmenami.
Stabilný prenos epigenetických informácií naprieč viacerými generáciami je dobre opísaný v rastlinných systémoch a C. elegánov, ale o jeho význame u cicavcov sa stále veľa diskutuje [36, 37]. Epigenetický základ pre prenos fenotypov starými rodičmi v reakcii na expozíciu v strave je dobre známy, a to aj u druhov hospodárskych zvierat [31]. Najvplyvnejšie štúdie demonštrujúce účinky epigenetického prenosu ovplyvňujúceho fenotyp potomstva použili príklad životaschopnej žltej myši aguti (Avy) [38]. U tejto myši inzercia retrotranspozónu upstream od génu agouti spôsobuje jeho konštitutívnu expresiu a následnú žltú farbu srsti a nástup obezity u dospelých. Materský prenos cez zárodočnú líniu vedie k umlčaniu expresie agouti sprostredkovanej metyláciou DNA, čo vedie k farbe srsti divokého typu a chudému fenotypu potomstva [39, 40]. Dôležité je, že následné štúdie na týchto myšiach ukázali, že vystavenie matiek donorom metylu spôsobuje zmenu farby srsti [41]. Jedna štúdia uvádza prenos fenotypu do generácie F3 a zmeny v expresii veľkého počtu génov v reakcii na obmedzenie proteínov vo F0 [42]; avšak zmeny v expresii boli veľmi variabilné a v tomto systéme nebola identifikovaná priama súvislosť s epigenetickými zmenami.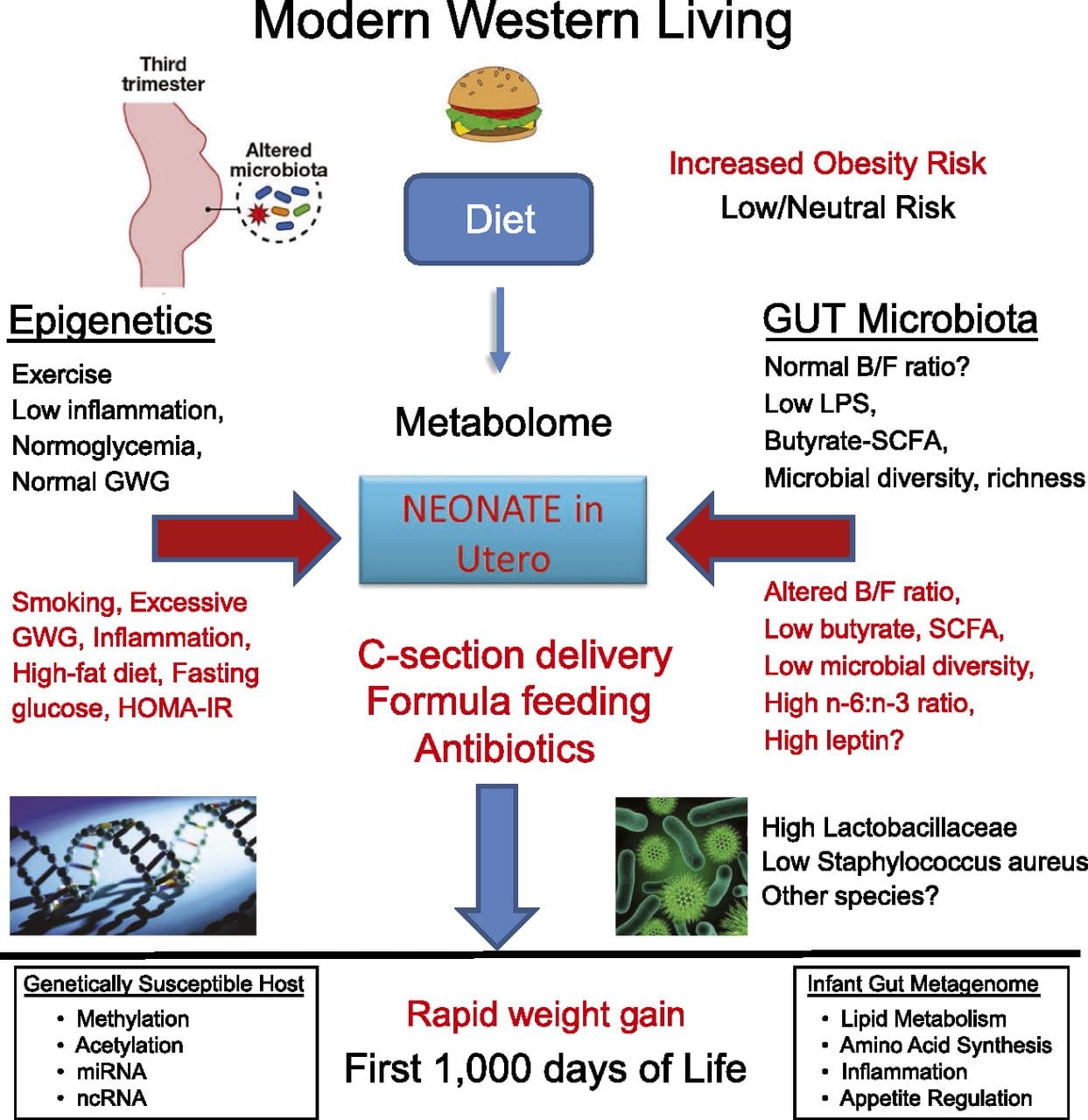 Zatiaľ čo mnohé štúdie identifikovali epigenetické zmeny súvisiace so stravou na zvieracích modeloch pomocou kandidátskych miestne špecifických oblastí, vykonalo sa len málo analýz v rámci celého genómu. Nedávna štúdia sa zamerala na určenie priameho epigenetického vplyvu diét s vysokým obsahom tukov / obezity vyvolanej diétou u dospelých myší pomocou génovej expresie v celom genóme a analýz metylácie DNA [43]. Táto štúdia identifikovala 232 rozdielne metylovaných oblastí (DMR) v adipocytoch z kontrolných myší a myší s vysokým obsahom tuku. Dôležité je, že zodpovedajúce ľudské oblasti pre myšie DMR boli tiež rozdielne metylované v tukovom tkanive z populácie obéznych a štíhlych ľudí, čím sa zdôraznila pozoruhodná evolučná konzervácia týchto oblastí. Tento výsledok zdôrazňuje pravdepodobný význam identifikovaných DMR pri regulácii energetickej homeostázy u cicavcov.
Zatiaľ čo mnohé štúdie identifikovali epigenetické zmeny súvisiace so stravou na zvieracích modeloch pomocou kandidátskych miestne špecifických oblastí, vykonalo sa len málo analýz v rámci celého genómu. Nedávna štúdia sa zamerala na určenie priameho epigenetického vplyvu diét s vysokým obsahom tukov / obezity vyvolanej diétou u dospelých myší pomocou génovej expresie v celom genóme a analýz metylácie DNA [43]. Táto štúdia identifikovala 232 rozdielne metylovaných oblastí (DMR) v adipocytoch z kontrolných myší a myší s vysokým obsahom tuku. Dôležité je, že zodpovedajúce ľudské oblasti pre myšie DMR boli tiež rozdielne metylované v tukovom tkanive z populácie obéznych a štíhlych ľudí, čím sa zdôraznila pozoruhodná evolučná konzervácia týchto oblastí. Tento výsledok zdôrazňuje pravdepodobný význam identifikovaných DMR pri regulácii energetickej homeostázy u cicavcov.
 i) Štúdie genetickej asociácie. Genetické polymorfizmy, ktoré sú spojené so zvýšeným rizikom vzniku konkrétnych stavov, sú a priori spojené s kauzálnymi génmi. Prítomnosť diferenciálnej metylácie v takýchto oblastiach vyvodzuje funkčnú relevanciu týchto epigenetických zmien pri kontrole expresie proximálneho génu (génov). Existujú silné cis-pôsobiace genetické účinky podporujúce veľkú epigenetickú variáciu [7, 45] a v štúdiách založených na populácii sa použili metódy, ktoré používajú genetické náhrady na odvodenie kauzálnej alebo sprostredkovateľskej úlohy rozdielov v epigenómoch [7, 46�48]. . Použitie familiárnej genetickej informácie môže tiež viesť k identifikácii potenciálne kauzálnych kandidátskych oblastí vykazujúcich fenotypovo súvisiacu diferenciálnu metyláciu [49].
i) Štúdie genetickej asociácie. Genetické polymorfizmy, ktoré sú spojené so zvýšeným rizikom vzniku konkrétnych stavov, sú a priori spojené s kauzálnymi génmi. Prítomnosť diferenciálnej metylácie v takýchto oblastiach vyvodzuje funkčnú relevanciu týchto epigenetických zmien pri kontrole expresie proximálneho génu (génov). Existujú silné cis-pôsobiace genetické účinky podporujúce veľkú epigenetickú variáciu [7, 45] a v štúdiách založených na populácii sa použili metódy, ktoré používajú genetické náhrady na odvodenie kauzálnej alebo sprostredkovateľskej úlohy rozdielov v epigenómoch [7, 46�48]. . Použitie familiárnej genetickej informácie môže tiež viesť k identifikácii potenciálne kauzálnych kandidátskych oblastí vykazujúcich fenotypovo súvisiacu diferenciálnu metyláciu [49].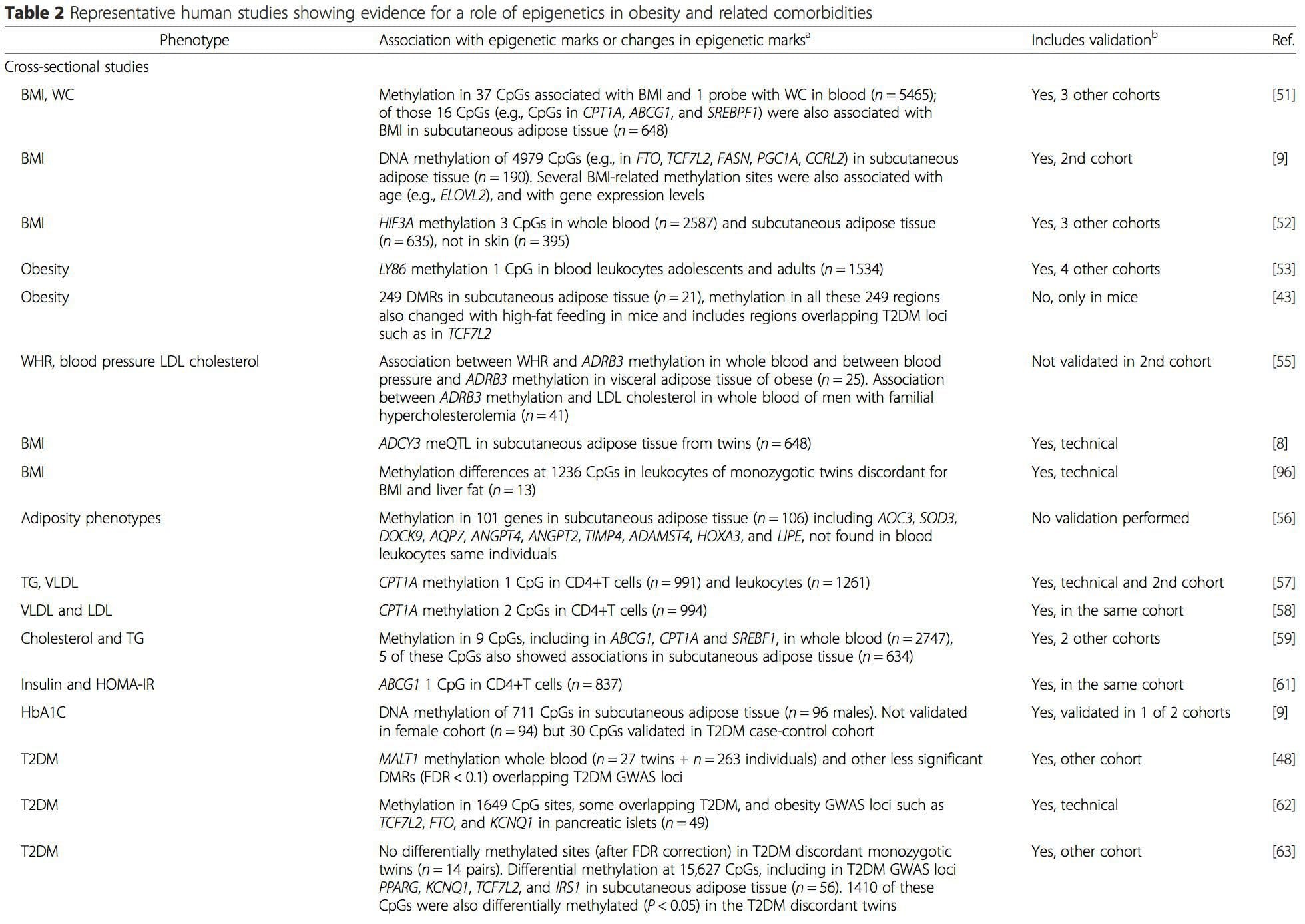
 Z týchto štúdií sa zmenená metylácia PGC1A, HIF3A, ABCG1 a CPT1A a predtým opísaná RXRA [18] ukázali ako biomarkery spojené s metabolickým zdravím alebo možno prediktívne pre metabolické zdravie, ktoré sú tiež pravdepodobnými kandidátmi na úlohu pri rozvoji metabolického ochorenia. .
Z týchto štúdií sa zmenená metylácia PGC1A, HIF3A, ABCG1 a CPT1A a predtým opísaná RXRA [18] ukázali ako biomarkery spojené s metabolickým zdravím alebo možno prediktívne pre metabolické zdravie, ktoré sú tiež pravdepodobnými kandidátmi na úlohu pri rozvoji metabolického ochorenia. .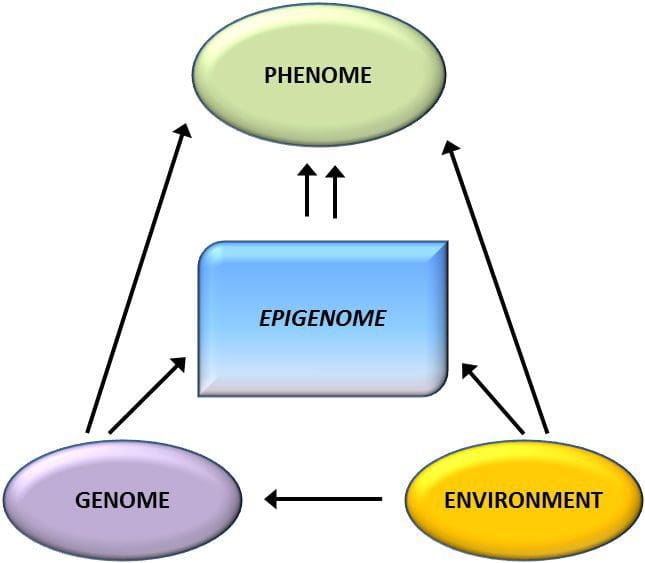 Epigenetická variácia je vysoko ovplyvnená základnou genetickou variáciou, pričom sa odhaduje, že genotyp vysvetľuje ~ 20 – 40 % variácie [6, 8]. Nedávno začalo množstvo štúdií integrovať metylómové a genotypové údaje na identifikáciu metylačných kvantitatívnych lokusov (meQTL) spojených s fenotypmi chorôb. Napríklad v tukovom tkanive sa v posilňovacom prvku pred ADCY3 identifikovalo prekrývanie meQTL s genetickým rizikovým lokusom BMI [8]. Iné štúdie tiež identifikovali prekrývanie medzi známou obezitou a rizikovými lokusmi T2DM a DMR spojenými s obezitou a T2DM [43, 48, 62]. Metylácia mnohých takýchto DMR bola tiež modulovaná kŕmením s vysokým obsahom tukov u myší [43] a stratou hmotnosti u ľudí [64]. Tieto výsledky identifikujú zaujímavú súvislosť medzi genetickými variáciami spojenými s náchylnosťou na ochorenie a ich asociáciou s oblasťami genómu, ktoré podliehajú epigenetickým modifikáciám v reakcii na nutričné výzvy, čo naznačuje kauzálny vzťah. Úzke spojenie medzi genetickou a epigenetickou variáciou môže znamenať ich podstatnú úlohu pri vytváraní individuálnych variácií [65, 66]. Aj keď tieto zistenia naznačujú, že metylácia DNA môže byť mediátorom genetických účinkov, je tiež dôležité zvážiť, že genetické aj epigenetické procesy by mohli pôsobiť nezávisle na rovnakých génoch. Štúdie dvojčiat [8, 63, 67] môžu poskytnúť dôležité poznatky a naznačujú, že interindividuálne rozdiely v úrovniach metylácie DNA vznikajú prevažne z nezdieľaného prostredia a stochastických vplyvov, minimálne zo zdieľaných environmentálnych účinkov, ale tiež s významným vplyvom genetických variácia.
Epigenetická variácia je vysoko ovplyvnená základnou genetickou variáciou, pričom sa odhaduje, že genotyp vysvetľuje ~ 20 – 40 % variácie [6, 8]. Nedávno začalo množstvo štúdií integrovať metylómové a genotypové údaje na identifikáciu metylačných kvantitatívnych lokusov (meQTL) spojených s fenotypmi chorôb. Napríklad v tukovom tkanive sa v posilňovacom prvku pred ADCY3 identifikovalo prekrývanie meQTL s genetickým rizikovým lokusom BMI [8]. Iné štúdie tiež identifikovali prekrývanie medzi známou obezitou a rizikovými lokusmi T2DM a DMR spojenými s obezitou a T2DM [43, 48, 62]. Metylácia mnohých takýchto DMR bola tiež modulovaná kŕmením s vysokým obsahom tukov u myší [43] a stratou hmotnosti u ľudí [64]. Tieto výsledky identifikujú zaujímavú súvislosť medzi genetickými variáciami spojenými s náchylnosťou na ochorenie a ich asociáciou s oblasťami genómu, ktoré podliehajú epigenetickým modifikáciám v reakcii na nutričné výzvy, čo naznačuje kauzálny vzťah. Úzke spojenie medzi genetickou a epigenetickou variáciou môže znamenať ich podstatnú úlohu pri vytváraní individuálnych variácií [65, 66]. Aj keď tieto zistenia naznačujú, že metylácia DNA môže byť mediátorom genetických účinkov, je tiež dôležité zvážiť, že genetické aj epigenetické procesy by mohli pôsobiť nezávisle na rovnakých génoch. Štúdie dvojčiat [8, 63, 67] môžu poskytnúť dôležité poznatky a naznačujú, že interindividuálne rozdiely v úrovniach metylácie DNA vznikajú prevažne z nezdieľaného prostredia a stochastických vplyvov, minimálne zo zdieľaných environmentálnych účinkov, ale tiež s významným vplyvom genetických variácia. Prenatálne prostredie: Dve nedávno publikované štúdie využili ľudské populácie, ktoré zaznamenali „prirodzené“ variácie v dodávke živín, na štúdium vplyvu výživy matiek pred alebo počas tehotenstva na metyláciu DNA u potomkov [68, 69]. V prvej štúdii sa použila gambijská kohorta matka-dieťa, aby preukázala, že sezónne variácie v príjme darcov metylu matkou počas tehotenstva a BMI matky pred tehotenstvom boli spojené so zmenenou metyláciou u dojčiat [69]. Druhá štúdia využila dospelých potomkov z kohorty Dutch Hunger Winter na skúmanie účinku prenatálnej expozície akútnemu obdobiu závažnej podvýživy matky na metyláciu DNA génov zapojených do rastu a metabolizmu v dospelosti [68]. Výsledky zdôraznili dôležitosť načasovania expozície v jej vplyve na epigenóm, pretože významné epigenetické účinky boli identifikované iba u jedincov vystavených hladomoru počas skorého tehotenstva. Dôležité je, že epigenetické zmeny sa vyskytli v spojení so zvýšeným BMI; v tejto štúdii však nebolo možné určiť, či tieto zmeny boli prítomné skôr v živote alebo ako dôsledok vyššieho BMI.
Prenatálne prostredie: Dve nedávno publikované štúdie využili ľudské populácie, ktoré zaznamenali „prirodzené“ variácie v dodávke živín, na štúdium vplyvu výživy matiek pred alebo počas tehotenstva na metyláciu DNA u potomkov [68, 69]. V prvej štúdii sa použila gambijská kohorta matka-dieťa, aby preukázala, že sezónne variácie v príjme darcov metylu matkou počas tehotenstva a BMI matky pred tehotenstvom boli spojené so zmenenou metyláciou u dojčiat [69]. Druhá štúdia využila dospelých potomkov z kohorty Dutch Hunger Winter na skúmanie účinku prenatálnej expozície akútnemu obdobiu závažnej podvýživy matky na metyláciu DNA génov zapojených do rastu a metabolizmu v dospelosti [68]. Výsledky zdôraznili dôležitosť načasovania expozície v jej vplyve na epigenóm, pretože významné epigenetické účinky boli identifikované iba u jedincov vystavených hladomoru počas skorého tehotenstva. Dôležité je, že epigenetické zmeny sa vyskytli v spojení so zvýšeným BMI; v tejto štúdii však nebolo možné určiť, či tieto zmeny boli prítomné skôr v živote alebo ako dôsledok vyššieho BMI. Postnatálne prostredie: Epigenóm sa vytvára de novo počas embryonálneho vývoja, a preto má prenatálne prostredie s najväčšou pravdepodobnosťou najvýznamnejší vplyv na epigenóm. Teraz je však jasné, že zmeny sa vyskytujú v „zrelom“ epigenóme pod vplyvom rôznych podmienok, vrátane starnutia, vystavenia toxínom a diétnych zmien. Napríklad zmeny v metylácii DNA v mnohých génoch v kostrovom svale a PGC1A v tukovom tkanive boli preukázané ako odpoveď na diétu s vysokým obsahom tukov [75, 76]. Zásahy na stratu telesného tuku boli tiež spojené so zmenami v metylácii DNA. Štúdie uvádzajú, že profily metylácie DNA tukového tkaniva [43, 64], mononukleárnych buniek periférnej krvi [77] a svalového tkaniva [78] u predtým obéznych pacientov sa po strate hmotnosti stávajú viac podobnými profilom štíhlych jedincov. Operácia na zníženie hmotnosti tiež čiastočne zvrátila metylačné zmeny v pečeni spojené s nealkoholickým stukovatením pečene [79] a v inej štúdii viedla k hypometylácii viacerých kandidátskych génov na obezitu s výraznejšími účinkami v subkutánnom v porovnaní s omentálnym (viscerálnym) tukom [64]. . Hromadné dôkazy naznačujú, že cvičebné zásahy môžu tiež ovplyvniť metyláciu DNA. Väčšina týchto štúdií bola vykonaná na štíhlych jedincoch [80–82], ale jedna cvičebná štúdia u obéznych jedincov s T2DM preukázala aj zmeny v metylácii DNA, vrátane génov zapojených do transportu mastných kyselín a glukózy [83]. Epigenetické zmeny sa vyskytujú aj so starnutím a najnovšie údaje naznačujú úlohu obezity pri ich rozširovaní [9, 84, 85]. Obezita urýchlila epigenetický vek pečeňového tkaniva, ale na rozdiel od vyššie popísaných zistení nebol tento efekt po strate hmotnosti reverzibilný [84].
Postnatálne prostredie: Epigenóm sa vytvára de novo počas embryonálneho vývoja, a preto má prenatálne prostredie s najväčšou pravdepodobnosťou najvýznamnejší vplyv na epigenóm. Teraz je však jasné, že zmeny sa vyskytujú v „zrelom“ epigenóme pod vplyvom rôznych podmienok, vrátane starnutia, vystavenia toxínom a diétnych zmien. Napríklad zmeny v metylácii DNA v mnohých génoch v kostrovom svale a PGC1A v tukovom tkanive boli preukázané ako odpoveď na diétu s vysokým obsahom tukov [75, 76]. Zásahy na stratu telesného tuku boli tiež spojené so zmenami v metylácii DNA. Štúdie uvádzajú, že profily metylácie DNA tukového tkaniva [43, 64], mononukleárnych buniek periférnej krvi [77] a svalového tkaniva [78] u predtým obéznych pacientov sa po strate hmotnosti stávajú viac podobnými profilom štíhlych jedincov. Operácia na zníženie hmotnosti tiež čiastočne zvrátila metylačné zmeny v pečeni spojené s nealkoholickým stukovatením pečene [79] a v inej štúdii viedla k hypometylácii viacerých kandidátskych génov na obezitu s výraznejšími účinkami v subkutánnom v porovnaní s omentálnym (viscerálnym) tukom [64]. . Hromadné dôkazy naznačujú, že cvičebné zásahy môžu tiež ovplyvniť metyláciu DNA. Väčšina týchto štúdií bola vykonaná na štíhlych jedincoch [80–82], ale jedna cvičebná štúdia u obéznych jedincov s T2DM preukázala aj zmeny v metylácii DNA, vrátane génov zapojených do transportu mastných kyselín a glukózy [83]. Epigenetické zmeny sa vyskytujú aj so starnutím a najnovšie údaje naznačujú úlohu obezity pri ich rozširovaní [9, 84, 85]. Obezita urýchlila epigenetický vek pečeňového tkaniva, ale na rozdiel od vyššie popísaných zistení nebol tento efekt po strate hmotnosti reverzibilný [84].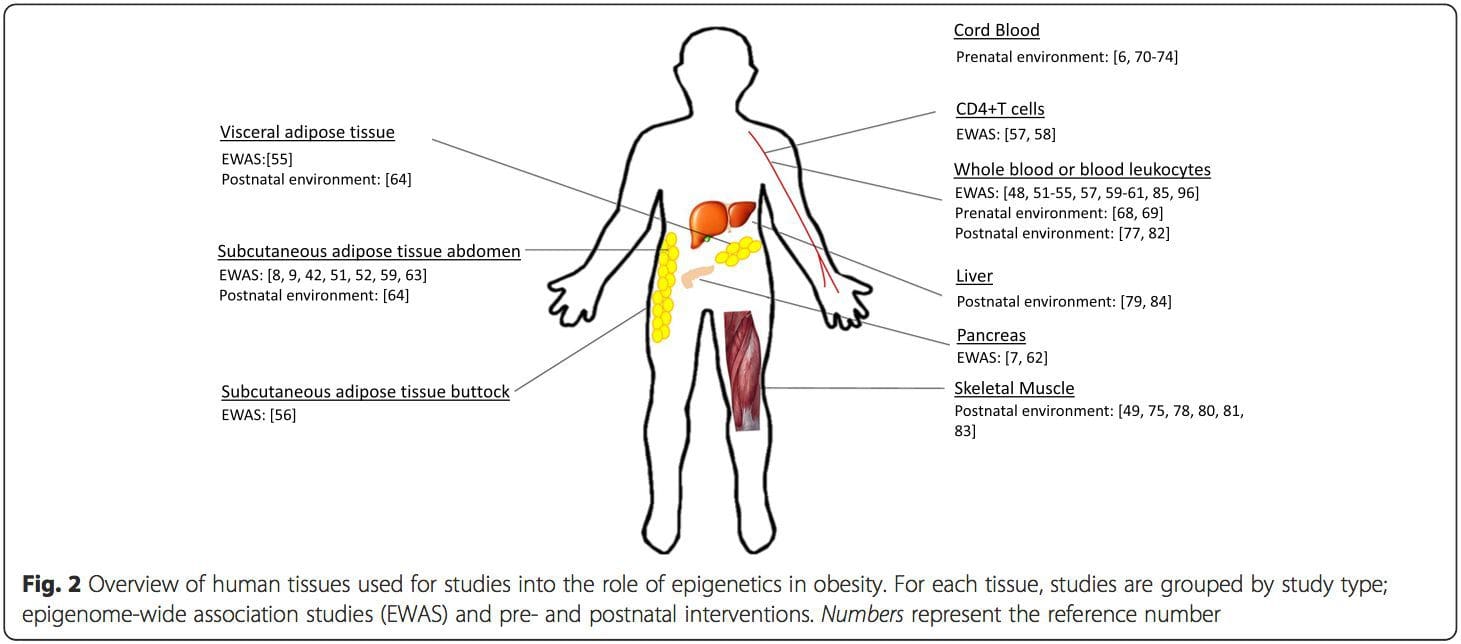 Závery
Závery



