Neurozápal:
abstraktné
Viaceré línie dôkazov podporujú patogénnu úlohu neurozápalu pri psychiatrickom ochorení. Zatiaľ čo systémové autoimunitné ochorenia sú dobre zdokumentovanými príčinami neuropsychiatrických porúch, synaptické autoimunitné encefalitídy s psychotickými symptómami sú často nedostatočne rozpoznané. Paralelne so spojením medzi psychiatrickými symptómami a autoimunitou pri autoimunitných ochoreniach sa neuroimunologické abnormality vyskytujú pri klasických psychiatrických poruchách (napríklad veľké depresívne, bipolárne, schizofrénie a obsedantno-kompulzívne poruchy). Výskumy patofyziológie týchto stavov tradične zdôrazňovali dysreguláciu glutamátergických a monoaminergných systémov, ale mechanizmy spôsobujúce tieto abnormality neurotransmiterov zostali nepolapiteľné. Preskúmali sme súvislosť medzi autoimunitou a neuropsychiatrickými poruchami a ľudskými a experimentálnymi dôkazmi podporujúcimi patogénnu úlohu neurozápalu pri vybraných klasických psychiatrických poruchách. Pochopenie toho, ako psychosociálne, genetické, imunologické a neurotransmiterové systémy interagujú, môže odhaliť patogénne stopy a pomôcť zamerať sa na nové preventívne a symptomatické terapie.
Kľúčové slová:
- Neurozápal,
- psychoneuroimunológia,
- astrocyt,
- mikroglia,
- cytokíny,
- Oxidačný stres,
- depresie,
- Obsesívno kompulzívna porucha,
- Bipolárna porucha, schizofrénia
Obsah
úvod
Keďže biologické abnormality sú čoraz častejšie identifikované medzi pacientmi s psychiatrickými poruchami, rozdiel medzi neurologickým a psychiatrickým ochorením sa stráca. Okrem systémových autoimunitných ochorení spojených s psychiatrickými prejavmi (napríklad lupus) [1] boli nedávno pacienti s akútnou izolovanou psychózou identifikovaní so synaptickou autoimunitnou encefalitídou (tab. 1) [2-6]. Títo pacienti sú často mylne diagnostikovaní s refraktérnymi primárnymi psychotickými poruchami, čo odďaľuje začatie účinnej imunoterapie (tabuľka 1). Okrem toho narastajúce dôkazy podporujú patogénnu úlohu antineuronálnych protilátok pri neuropsychiatrických poruchách [7].
Oddelenie neurologických a psychiatrických porúch podporované Descartovou koncepciou „mysle“ ako ontologicky odlišnej entity a reprodukovateľnosťou neuropatologických abnormalít dominovalo v medicíne�19. a začiatkom 20. storočia [8]. Odvtedy rozširujúca sa zbierka reprodukovateľných biologických príčin, od neurosyfilisu, úrazu hlavy, mŕtvice, nádoru, demyelinizácie a mnohých ďalších, spôsobila komplexy symptómov, ktoré sa prekrývali s klasickými psychiatrickými poruchami [9-11]. Nedávno boli u pacientov s klasickými psychiatrickými poruchami zdokumentované neurozápalové a imunologické abnormality.
Periférne imunitné modulátory môžu vyvolať psychiatrické symptómy u zvieracích modelov a ľudí [12-19]. Zdravým zvieratám bol podaný prozápalový IL-1? a cytokíny tumor nekrotizujúceho faktora alfa (TNF-?) demonštrujú „chorobné správanie“ spojené so sociálnym stiahnutím sa [12]. U ľudí injekcie nízkej dávky endotoxínu deaktivujú ventrálne striatum, oblasť kritickú pre spracovanie odmeny, čo spôsobuje anhedóniu, oslabujúci depresívny symptóm [14]. Približne 45 % pacientov s hepatitídou C a rakovinou bez depresie liečených IFN-? vyvinúť depresívne symptómy spojené so zvýšenou hladinou IL-6 v sére [12,15,17,18].
Zdravotné stavy spojené s chronickými zápalovými a imunologickými abnormalitami, vrátane obezity, cukrovky, malignít, reumatoidnej artritídy a roztrúsenej sklerózy, sú rizikovými faktormi pre depresiu a bipolárnu poruchu [10,12,13,15,17,18]. Pozitívne�korelácia medzi týmito zdravotnými stavmi a psychiatrickým ochorením naznačuje prítomnosť rozšíreného základného zápalového procesu postihujúceho mozog medzi inými orgánmi [10,19,20]. 30-ročná populačná štúdia ukázala, že s autoimunitné ochorenie alebo predchádzajúca hospitalizácia pre závažnú infekciu zvýšila riziko rozvoja schizofrénie o 29 % a 60 % [16]. Okrem toho vírus herpes simplex, Toxoplasma gondii, cytomegalovírus a chrípka počas tehotenstva zvyšujú riziko vzniku schizofrénie [16].
Periférne bunkové [21,22] (tabuľka 2) a humorálne imunologické abnormality [13,21-23] sú častejšie u psychiatrických pacientov v porovnaní so zdravými kontrolami. V pilotných štúdiách (n = 34 pacientov s veľkou depresívnou poruchou (MDD), n = 43 zdravých kontrol) a replikačných štúdiách (n = 36 MDD, n = 43 zdravých kontrol) sérový test zahŕňajúci deväť sérových biomarkerov odlišoval subjekty s MDD od zdravých kontroly s 91.7 % senzitivitou a 81.3 % špecifickosťou; významne zvýšené biomarkery pre neuropsychiatrické symptómy boli imunologické molekuly alfa 1 antitrypsín, myeloperoxidáza a rozpustný TNF-? receptor II [23].
 Najprv preskúmame súvislosť medzi autoimunitou a neuropsychiatrickými poruchami, vrátane: 1) systémového lupus erythematosus (SLE) ako prototypu systémového autoimunitného ochorenia; 2) autoimunitné encefalitídy spojené so sérovými antisynaptickými a autoprotilátkami dekarboxylázy kyseliny glutámovej (GAD); a 3) detské neuropsychiatrické autoimunitné poruchy spojené so streptokokovými infekciami (PANDAS) a čistou obsedantno-kompulzívnou poruchou (OCD) spojenou s autoprotilátkami proti bazálnym gangliám/talamom. Potom diskutujeme o úlohe vrodeného zápalu / autoimunity pri klasických psychiatrických poruchách, vrátane MDD, bipolárnej poruchy (BPD), schizofrénie a OCD.
Najprv preskúmame súvislosť medzi autoimunitou a neuropsychiatrickými poruchami, vrátane: 1) systémového lupus erythematosus (SLE) ako prototypu systémového autoimunitného ochorenia; 2) autoimunitné encefalitídy spojené so sérovými antisynaptickými a autoprotilátkami dekarboxylázy kyseliny glutámovej (GAD); a 3) detské neuropsychiatrické autoimunitné poruchy spojené so streptokokovými infekciami (PANDAS) a čistou obsedantno-kompulzívnou poruchou (OCD) spojenou s autoprotilátkami proti bazálnym gangliám/talamom. Potom diskutujeme o úlohe vrodeného zápalu / autoimunity pri klasických psychiatrických poruchách, vrátane MDD, bipolárnej poruchy (BPD), schizofrénie a OCD.
Neuropsychiatrické poruchy spojené s autoimunitou
Systémový lupus erythematosus
25 % až 75 % pacientov so SLE má postihnutie centrálneho nervového systému (CNS), pričom psychiatrické symptómy sa typicky vyskytujú počas prvých dvoch rokov od začiatku ochorenia. Psychiatrické symptómy môžu zahŕňať úzkosť, náladu a psychotické poruchy [97]. Zobrazovanie magnetickou rezonanciou mozgu (MRI) je normálne v približne 42 % prípadov neuropsychiatrického SLE [97]. Mikroangiopatia a rozpad hematoencefalickej bariéry (BBB) môžu umožniť vstup autoprotilátok do mozgu [97]. Tieto protilátky zahŕňajú anti-ribozomálny P (pozitívny u 90 % psychotických pacientov so SLE) [1], anti-endoteliálne bunky, anti-gangliozid, anti-dsDNA, anti-2A/2B podjednotky N-metyl-D-aspartátových receptorov ( NMDAR) a antifosfolipidové protilátky [97]. Prozápalové cytokíny�hlavne IL-6 [97], S100B�[97], intracelulárna adhézna molekula 1 [97] a matrix- metaloproteináza-9 [98] sú pri SLE tiež zvýšené. Psychiatrické prejavy SLE, Sjo? Grenovej choroby, Susacovho syndrómu, CNS vaskulitídy, CNS Whippleovej choroby a Behcétovej choroby boli nedávno preskúmané [1].
Neuropsychiatrické autoimunitné encefalitídy spojené so sérovou antisynaptickou a dekarboxylázou kyseliny glutámovej
autoprotilátky
Autoimunitné encefalitídy sú charakterizované akútnym nástupom záchvatov temporálneho laloka, psychiatrickými črtami a kognitívnymi deficitmi [2,3,99-108]. Patofyziológia je typicky sprostredkovaná autoprotilátkami zameranými na synaptické alebo intracelulárne autoantigény v spojení s paraneoplastickým alebo neparaneoplastickým pôvodom [3]. Antisynaptické autoprotilátky sa zameriavajú na NR1 podjednotky NMDAR [100,108,109], komplexy napäťovo riadených draslíkových kanálov (VGKC) (Kv1 podjednotka, glióm bohatý na leucín inaktivovaný (LGI1) a proteín asociovaný s kontaktínom 2 (CASPR2) a 101,102,106, G1, GluR2 podjednotky receptora amino-3-hydroxy-5-metyl-4-6,110,111-izoxazolpropiónovej kyseliny (AMPAR) [1] a B3,99,103 podjednotky B receptorov kyseliny a-aminomaslovej (GABABR) [65]. Anti-intracelulárne autoprotilátky sa zameriavajú na onkoneuronálne a GAD-2,3 autoantigény [XNUMX].
Zápal spojený s antisynaptickými autoprotilátkami, najmä autoprotilátkami NMDAR, je zvyčajne oveľa miernejší ako zápal spojený s autoprotilátkami GAD alebo antineurónovými autoprotilátkami súvisiacimi so systémovými autoimunitnými poruchami alebo paraneoplastickými syndrómami [2,107].
Hoci neurologické symptómy sa nakoniec objavia, psychiatrické prejavy, od úzkosti [2,3] po psychózu napodobňujúcu schizofréniu [2–6], môžu spočiatku dominovať alebo predchádzať neurologickým prejavom. Až dve tretiny pacientov s anti-NMDAR autoimunitnou encefalitídou sú pôvodne psychiatrické služby [5]. Antisynaptické protilátky sprostredkované autoimunitnými encefalitídami sa musia brať do úvahy pri diferenciálnej diagnostike akútnej psychózy [2–6]. Psychiatrické prejavy môžu zahŕňať normálnu MRI mozgu a analýzu cerebrospinálnej tekutiny (CSF) bez encefalopatie alebo záchvatov [2,3,5,6,107]. Uviedli sme prípad séropozitívnych autoprotilátok GAD spojených s biopsiou potvrdeným neurozápalom, napriek normálnym analýzam MRI mozgu a CSF, kde pacient vykazoval izolovanú psychózu diagnostikovanú ako schizofrénia podľa kritérií Diagnostic and Statistical Manual of Mental Disorders, 4. vydanie (DSM-IV). [2]. Okrem toho sa séronegatívne autoimunitné encefalitídy môžu prejaviť aj výraznými neuropsychiatrickými poruchami, vďaka čomu je diagnóza obtiažnejšia [107,112,113]. Psychiatrické a neurologické znaky spojené s antisynaptickými a GAD autoprotilátkami sú zhrnuté v tabuľke 1 [1-6,99-108,114].
Sérové antisynaptické a GAD autoprotilátky sa môžu vyskytnúť u pacientov s čisto psychiatrickými poruchami [2,4,5,112,115-121]. V prospektívnej kohorte 29 jedincov, ktorí spĺňali kritériá DSM-IV pre schizofréniu, sa sérové anti-NMDAR autoprotilátky našli u troch jedincov a autoprotilátky proti komplexu VGKC sa našli u jedného jedinca [5]. Použitím citlivejších techník na detekciu autoprotilátok NR1 imunoglobulínu G (IgG) u 100 pacientov s definitívnou schizofréniou sa nezistili žiadne autoprotilátky [122]. Táto štúdia však nehodnotila autoprotilátky zamerané na podjednotku NR2 NMDAR. Iné štúdie uvádzali významne zvýšenú pravdepodobnosť zvýšených (≥ 90. percentil nepsychiatrických kontrolných hladín) hladín protilátok NR2 (pomer pravdepodobnosti (OR) 2.78, 95 % interval spoľahlivosti (CI) 1.26 až 6.14, P = 0.012) medzi jednotlivcami s akútnou mániou ( n = 43), ale nie pri chronickej mánii alebo schizofrénii [116].
PANDAS a čistá obsedantno-kompulzívna porucha spojená s antibazálnymi gangliovými/talamickými autoprotilátkami
OCD často komplikuje neurologické poruchy zahŕňajúce bazálne gangliá vrátane Sydenhamovej chorey, Huntingtonovej choroby a Parkinsonovej choroby. Protilátky proti bazálnym gangliám sa podieľajú na Sydenhamovej choree [123]. PANDAS je charakterizovaný akútnymi exacerbáciami symptómov OCD a/alebo motorických/fonických tikov po prodromálnej β-hemolytickej streptokokovej infekcii skupiny A. Predpokladá sa, že patofyziológia zahŕňa skríženú reaktivitu medzi antistreptokokovými protilátkami a proteínmi bazálnych ganglií [124]. Klinické prekrytie medzi PANDAS a čistou OCD naznačuje spoločný etiologický mechanizmus [125].
V náhodnej kohorte 21 pacientov s čistou OCD malo 91.3 % antibazálne gangliá (P <0.05) a antitalamické autoprotilátky (P <0.005) pri 43 kDa [88], čo je paralelné s funkčnými abnormalitami v kortiko-striatálnom-talame -kortikálny obvod pacientov s OCD [84]. Ďalšia štúdia dokumentovala, že 42 % (n = 21) pediatrických a dospievajúcich jedincov s OCD malo sérové autoprotilátky proti bazálnym gangliám pri 40, 45 a 60 kDa v porovnaní s 2 % až 10 % kontrol (P = 0.001) [7]. Autoprotilátky proti bazálnym gangliám boli detegované v sére 64 % subjektov PANDAS (n = 14), v porovnaní s iba 9 % (n = 2) streptokokovo-pozitívnych/OCD-negatívnych kontrol (P <0.001) [126]. Jedna štúdia nezistila žiadny rozdiel medzi prevalenciou autoprotilátok proti bazálnym gangliám pri OCD (5.4 %, n = 4) oproti kontrolám MDD (0 %) [127]; obmedzením však bolo náhodné použitie kôry potkana a bazálnych ganglií a kôry hovädzieho dobytka, ktoré mohlo obmedziť identifikáciu séropozitívnych prípadov.
Autoantigény bazálnych ganglií sú aldoláza C (40 kDa), neuronálne špecifická/neneuronálna enoláza (45 kDa dublet) a pyruvátkináza M1 (60 kDa)�neurónové glykolytické enzýmy�zapojené do neurotransmisie, metabolizmu neurónov
Strana 3 z 24 a bunkovej signalizácie [128]. Tieto enzýmy vykazujú podstatnú štrukturálnu homológiu so streptokokovými proteínmi [129]. Najnovšia štúdia (96 OCD, 33 MDD, 17 pacientov so schizofréniou) testovala sérum pacientov proti pyruvátkináze, aldoláze C a enoláze, konkrétne; väčšia časť pacientov s OCD bola séropozitívna v porovnaní s kontrolami (19.8 % (n = 19) oproti 4 % [n = 2], P = 0.012) [130].
Napriek tomu v tej istej štúdii len jeden z 19 séropozitívnych jedincov s OCD mal tiež pozitívne titre protilátok proti streptolyzínu O, čo naznačuje, že v čistom OCD séronegativita protilátok proti streptolyzínu O nevylučuje prítomnosť autoprotilátok proti bazálnym gangliám. .
Pri čistej OCD je séropozitivita na protilátky proti bazálnym gangliám/talamom spojená so zvýšenými hladinami glycínu v CSF (P = 0.03) [88], čo naznačuje, že tieto protilátky prispievajú k hyperglutamatergii pozorovanej pri OCD [84,88,131]. Zlepšenie infekciou vyvolaného OCD pomocou imunitných terapií podporuje patogenitu týchto autoprotilátok [132]. Prebieha veľká štúdia NIH hodnotiaca účinnosť intravenózneho imunoglobulínu (IVIG) u detí s akútnym nástupom OCD a antistreptokokovými protilátkami (ClinicalTrials.gov: NCT01281969). Avšak zistenie mierne vyšších hladín glutamátu v CSF u pacientov s OCD s negatívnymi protilátkami proti bazálnym gangliám/talamom v CSF v porovnaní s pacientmi s pozitívnymi protilátkami v CSF naznačuje, že pri OCD môžu hrať úlohu neimunologické mechanizmy [84]. Ďalšie mechanizmy, vrátane zápalu sprostredkovaného cytokínmi (tabuľka 2), sú tiež hypotetické.
Psychiatrické poruchy spojené s vrodeným zápalom
Poruchy vrodeného zápalu/autoimunity sa vyskytujú u niektorých pacientov s klasickými psychiatrickými poruchami. Diskutujeme o vrodených abnormalitách CNS súvisiacich so zápalom vrátane gliálnej patológie, zvýšených hladín cytokínov, aktivácie cyklooxygenázy, dysregulácie glutamátu, zvýšených hladín S100B, zvýšeného oxidačného stresu a dysfunkcie BBB pri MDD, BPD, schizofrénii a OCD. Opisujeme tiež, ako môže byť vrodený zápal mechanicky spojený s tradičnými monoaminergnými a glutamátergickými abnormalitami hlásenými pri týchto poruchách (obrázky 1 a 2). Je tiež zhodnotená terapeutická úloha protizápalových činidiel pri psychiatrických poruchách.
 Astrogliálna a oligodendrogliálna histopatológia
Astrogliálna a oligodendrogliálna histopatológia
Astroglia a oligodendroglia sú nevyhnutné pre neurálne metabolický homeostázy, správania a vyšších kognitívnych funkcií [54-56,133-136]. Normálna pokojová astroglia poskytuje neurónom energiu a trofickú podporu, reguluje synaptickú neurotransmisiu (obrázok 2), synaptogenézu, prietok krvi mozgom a udržiava integritu BBB [134,136,137, XNUMX, XNUMX]. Zrelé oligodendroglie poskytujú energiu a trofickú podporu neurónov a udržiavajú integritu BBB a regulujú opravu axónov�a myelinizácia dráh bielej hmoty poskytujúca inter- a intrahemisférickú konektivitu [54-56]. Astroglia aj oligodendroglia produkujú protizápalové cytokíny, ktoré môžu down-regulovať škodlivý zápal [52,55].
Pri MDD je astrogliálna strata konzistentným posmrtným nálezom vo funkčne relevantných oblastiach, vrátane prednej cingulárnej kôry, prefrontálneho kortexu, amygdaly a bielej hmoty [35-38,42-46,55,138-147], s niekoľkými výnimkami [42,43 ,37,38]. Postmortálne štúdie odhalili zníženú astrogliálnu hustotu pozitívnu na gliálny fibrilárny kyslý proteín (GFAP) predovšetkým v prefrontálnom kortexe [36] a amygdale [39]. Veľká proteomická analýza frontálnych kortexov u depresívnych pacientov ukázala významné zníženie troch izoforiem GFAP [75]. Hoci v jednej štúdii, ktorá nezaznamenala žiadnu významnú stratu glií, analýza podskupín odhalila významný pokles (45 %) v GFAP-pozitívnej astrogliálnej hustote u skúmaných subjektov mladších ako 35 rokov [148]. Morfometrická štúdia podobne nepreukázala žiadne zmeny v hustote glií v mozgoch MDD v neskoršom veku [35]. Predpokladáme, že zjavná absencia astrogliálnej straty u starších pacientov s MDD môže odzrkadľovať sekundárnu astrogliózu [42,50], ktorá je spojená s vyšším vekom [XNUMX], a nie skutočné negatívum.
Štúdie na zvieratách sú v súlade so štúdiami u ľudí, ktoré ukazujú astrogliálnu stratu pri MDD. Potkany Wistar-Kyoto, o ktorých je známe, že vykazujú depresívne správanie, odhalili zníženú astrogliálnu hustotu v rovnakých oblastiach, aké boli pozorované u ľudí [40]. Podávanie astrogliálneho toxického činidla, kyseliny L-alfa-aminoadipovej, vyvoláva u potkanov depresívne symptómy, čo naznačuje, že strata astroglií je pri MDD patogénna [41].
Posmrtné štúdie subjektov s MDD dokumentovali zníženú oligodendrogliálnu hustotu v prefrontálnom kortexe a amygdale [54-57,66], čo môže korelovať s Fokálnymi zmenami bielej hmoty mozgu na MRI, ktoré boli príležitostne zaznamenané u niektorých pacientov s MDD [57]. K týmto zmenám však môžu prispieť aj mikrovaskulárne abnormality [57].
Pri BPD niektoré štúdie preukazujú významnú stratu glií [138,143,149,150], zatiaľ čo iné nie [37,44-46]. Tieto nekonzistentné zistenia môžu vyplývať z nedostatočnej kontroly pri: 1) liečbe stabilizátormi nálady, pretože post-hoc analýza uvádzaná v niektorých štúdiách preukázala významné zníženie straty glií až po kontrole liečby lítiom a kyselinou valproovou [46]; 2) familiárne formy BPD, keďže strata glií je obzvlášť výrazná u pacientov s BPD so silnou rodinnou anamnézou [143]; a/alebo 3) prevládajúci stav depresie oproti mánii, keďže strata glií je pri MDD častá [35-38,42-46,55,138-147]. Nie je jasné, či astroglia alebo oligodendroglia spôsobujú väčšinu straty glií; zatiaľ čo proteomická analýza odhalila významný pokles jednej astrogliálnej izoformy GFAP [39], niekoľko ďalších post-mortem štúdií zistilo buď nezmenenú [36,37] alebo zníženú GFAP-pozitívnu astrogliálnu expresiu v orbitrofrontálnom kortexe [47] alebo zníženú oligodendrogliálnu hustotu [ 54-56,58,59].
Pri schizofrénii je astrogliálna strata nekonzistentným nálezom [48,150]. Zatiaľ čo niektoré štúdie nepreukázali žiadnu významnú astrogliálnu stratu [42,50,51], niekoľko ďalších zistilo zníženú astrogliálnu hustotu [37,38,43,44,48,49,151] a významné zníženie dvoch izoforiem GFAP [39]. Nekonzistentné nálezy môžu vyplynúť z: 1) komorbidity MDD, ktorá je často spojená so stratou glií; 2) vekové variácie, keďže starší pacienti majú zvýšenú GFAP-pozitívnu astrogliu [35,42,50]; 3) regionálna [150] a variabilita kortikálnej vrstvy [48]; 4) liečba antipsychotikami, keďže experimentálne štúdie ukazujú zníženú [152] aj zvýšenú [153] astrogliálnu hustotu súvisiacu s chronickou antipsychotickou liečbou [70]; a 5) chorobný stav (napríklad samovražedné verzus nesuicidálne správanie) [154]. Postmortálne štúdie dokumentovali stratu oligodendroglií [54,56,60-65,148,155,156], najmä v prefrontálnom kortexe, prednom cingulárnom kortexe a hipokampe [148]. Ultraštrukturálne vyšetrenie prefrontálnej oblasti ukázalo abnormálne myelinizované vlákna v sivej aj bielej hmote; vek aj trvanie ochorenia pozitívne korelovali s abnormalitami bielej hmoty [157].
Na rozdiel od neurodegeneratívnych porúch, ktoré sú bežne spojené s astrogliálnou proliferáciou [136], psychiatrické poruchy sú namiesto toho spojené buď so zníženou alebo nezmenenou astrogliálnou hustotou [138]. Nedostatok zvýšenej hustoty glií pri včasnom nástupe psychiatrických porúch [44,138] môže odrážať pomalšiu rýchlosť degeneratívnej progresie psychiatrických ochorení [138].
Predpokladáme, že degeneratívne zmeny spojené s psychiatrickými poruchami sú jemnejšie a nie sú dostatočne závažné na to, aby vyvolali astrogliálne intracelulárne transkripčné faktory, ktoré pozitívne regulujú astrogliózu, vrátane signálneho transduktora aktivátora transkripcie 3 a jadrového faktora kappa B (NF-?B) [136].
Zatiaľ čo väčšina post-mortem štúdií sa zamerala na zmenu hustoty glií pri MDD, BPD a schizofrénii, iné opísali zmenu morfológie gliových buniek so zmiešanými zisteniami. Pri MDD a BPD je veľkosť glií buď zvýšená alebo nezmenená [55]. Jedna štúdia zistila zníženú veľkosť glií pri BPD a schizofrénii, ale nie pri MDD [43]. V postmortálnej štúdii u depresívnych pacientov, ktorí spáchali samovraždu, sa zistila zvýšená veľkosť astroglie v prednej cingulárnej bielej hmote, ale nie v kôre [158]. Jedna štúdia u schizofrenických jedincov zistila výrazne zníženú veľkosť astroglie vo vrstve V dorzolaterálneho prefrontálneho kortexu, bez ohľadu na to, že hustota astroglie je dvojnásobná v porovnaní s kontrolnou hustotou v tej istej vrstve [48]. Zmiešané výsledky môžu čiastočne odrážať skoršie štúdie gliových zmien pri psychiatrických ochoreniach, ktoré nešpecifikovali astrogliu oproti oligodendroglii [148].
Strata glií pri psychiatrických ochoreniach môže prispieť k neurozápalu prostredníctvom niekoľkých mechanizmov, vrátane abnormálnych hladín cytokínov (pozri časť Cytokíny), dysregulovaného metabolizmu glutamátu (pozri časť Glutamát), zvýšeného proteínu S100B (pozri časť S100B),�a zmenená funkcia BBB (pozri časť Hematoencefalická bariéra), čo má za následok zhoršenú kogníciu a správanie [44,45,54,133,159].
Mikrogliálna histopatológia
Mikroglie sú rezidentné imunitné bunky CNS. Poskytujú nepretržitý imunitný dohľad a regulujú vývojové synaptické prerezávanie [160,161]. Poškodenie CNS transformuje rozvetvené pokojové mikroglie na aktivované predĺžené tyčinkovité a makrofágom podobné fagocytárne améboidné bunky, ktoré proliferujú a migrujú smerom k miestu poškodenia pozdĺž chemotaktických gradientov (t. j. mikrogliálna aktivácia a proliferácia (MAP)) [161]. Ľudské mikrogliálne bunky exprimujú NMDAR, ktoré môžu sprostredkovať MAP vedúce k poškodeniu neurónov [162].
V prípade MDD, BPD a schizofrénie sú výsledky postmortálnych štúdií skúmajúcich prítomnosť MAP zmiešané. Postmortálne štúdie odhalili zvýšenú MAP len u jedného z piatich jedincov s MDD [67]. U niektorých pacientov s poruchou BPD bol vo frontálnom kortexe dokumentovaný zvýšený výskyt mikroglií pozitívnych na ľudský leukocytový antigén-DR s prejavmi zhrubnutých výbežkov [69]. Pri schizofrénii, kým niektoré štúdie uvádzali zvýšenú MAP v porovnaní s kontrolami, iné nepreukázali žiadny rozdiel medzi skupinami [22,67,70]. V postmortálnej štúdii hodnotiacej MAP v MDD a BPD; Hustota mikrogliálnych buniek pozitívnych na kyselinu chinolínovú bola zvýšená v subgenuálnom prednom cingulárnom kortexe a prednom strednom cingulárnom kortexe pacientov s MDD a BPD, ktorí spáchali samovraždu v porovnaní s kontrolami [53]. Post-hoc analýza odhalila, že tento zvýšený MAP možno pripísať výlučne MDD a nie BPD, pretože pozitívne mikrogliálne imunofarbenie u subjektov s MDD bolo významne väčšie ako v podskupine BPD v subgenuálnej prednej cingulárnej aj strednej cingulárnej kôre, a keďže hustota mikroglií bola podobná v BPD aj v kontrolnej skupine [53]. Štúdia porovnávajúca všetky tri poruchy (deväť MDD, päť BPD, štrnásť schizofrénie, desať zdravých kontrol) nepreukázala žiadny významný rozdiel v mikrogliálnej hustote medzi týmito štyrmi skupinami [68].
Tieto zmiešané výsledky možno pripísať variabilným mikrogliálnym imunologickým markerom používaným v rôznych štúdiách [70] a/alebo zlyhaniu kontroly závažnosti ochorenia [22,53,68]. Najmä tri postmortálne štúdie MDD a schizofrenických jedincov dokumentovali silnú pozitívnu koreláciu medzi MAP a suicidalitou v prednej cingulárnej kôre a mediodorzálnom talame, nezávisle od psychiatrickej diagnózy [22,53,68]. MAP teda môže byť skôr stavom ako znakovým znakom pre MDD a schizofréniu.
Pri OCD zvieracie modely naznačujú, že dysfunkcia a redukcia určitých mikrogliálnych fenotypov, ako sú tie, ktoré exprimujú gén Hoxb8, ktorý kóduje transkripčný faktor homeoboxu, môže spôsobiť správanie podobné OCD [71,72].
Knokautované myši Hoxb8 vykazujú nadmernú starostlivosť a úzkosť v spojení so zníženou hustotou mikroglií [71,72]. Toto nadmerné ošetrovanie sa podobá behaviorálnym charakteristikám ľudskej OCD. Injekcia Hoxb8 u dospelých knockoutovaných myší Hoxb8 zvráti stratu mikroglie a obnoví normálne správanie [71,72]. Úloha týchto špecifických mikrogliálnych fenotypov v ľudskom OCD je nejasná.
Experimentálne údaje naznačujú, že MAP obsahuje výrazné škodlivé a neuroprotektívne fenotypy (obrázok 2). Škodlivé mikroglie neexprimujú hlavný histokompatibilný komplex II (MHC-II), a preto nemôžu pôsobiť ako bunky prezentujúce antigén (APC) [163,164]; podporujú škodlivé účinky [17,69,165] prostredníctvom prozápalovej produkcie cytokínov, signalizácie syntázy oxidu dusnatého [17,166], podporujú expresiu gliovej a BBB-pericytovej/endoteliálnej cyklooxygenázy-2 (COX-2) [167], indukujú astrogliálnu sekréciu S100B (pozri časť) a uvoľňovanie mikrogliálneho glutamátu [100]. Škodlivé mikroglie tiež vylučujú prostaglandín E-17,136,168,169 (PGE-2), ktorý podporuje produkciu prozápalových cytokínov, čo následne zvyšuje hladiny PGE-2 v doprednom cykle [2]. Okrem toho PGE-29 stimuluje expresiu COX-2, ktorá sprostredkúva konverziu kyseliny arachidónovej na PGE-2, čím sa nastavuje ďalší dopredný cyklus [2].
Neuroprotektívne mikroglie môžu naopak: 1) exprimovať MHC-II in vivo a in vitro [163,166] a pôsobiť ako príbuzné APC (obrázok 2) [163,164,166]; 2) uľahčujú hojenie a obmedzujú poškodenie neurónov podporou sekrécie protizápalových cytokínov [17], neurotrofického faktora odvodeného od mozgu [17] a rastového faktora podobného inzulínu-1 [166]; a 3) exprimovať excitačný aminokyselinový transportér-2 (EAAT2), ktorý eliminuje nadbytok extracelulárneho glutamátu [163,166, 2] a podporuje neuroprotektívnu autoimunitu T lymfocytov (obrázok 163,164) [XNUMX, XNUMX]. Je však potrebných viac štúdií na potvrdenie úlohy neuroprotektívnej mikroglie, ktorá prispieva k neuropsychiatrickým poruchám u ľudí.
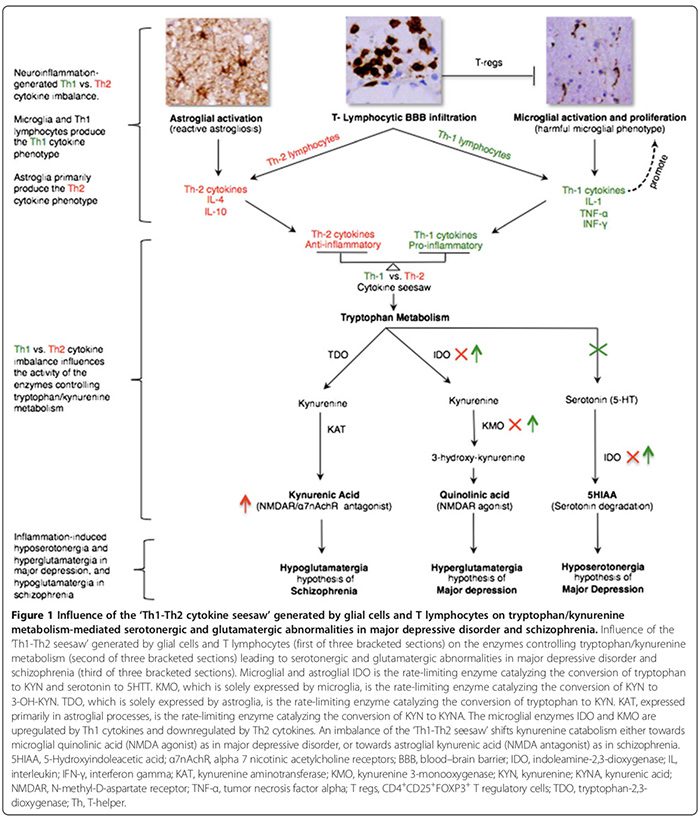
In vitro štúdie na zvieratách naznačujú, že pomer škodlivých a neuroprotektívnych mikroglií môže byť ovplyvnený čistým účinkom zápalových kontraregulačných mechanizmov [15,74,164,166]. Tieto mechanizmy zahŕňajú počet neuroprotektívnych CD4+CD25+FOXP3+ T regulačných buniek ((T regs) Obrázok 1) [15,74,164,166] a hladiny mozgových cytokínov; nízky IFN-? hladiny môžu podporovať neuroprotektívne mikroglie (obrázok 2) [166], zatiaľ čo vysoké hladiny môžu podporovať škodlivý fenotyp [166].
Úloha cytokínov
Prozápalové cytokíny zahŕňajú IL-1a, IL-2, IL-6, TNF-a. a IFN-y. Vylučujú ich predovšetkým mikroglie, Th1 lymfocyty a monocyty/makrofágy fenotypu M1 (obrázok 1) [15,170]. Podporujú škodlivé zápaly. Protizápalové cytokíny zahŕňajú IL-4, IL-5 a IL-10. Primárne ich vylučuje astroglia,�Th2 lymfocyty, T regs a monocyty/makrofágy fenotypu M2 [15,52,74]. Môžu obmedziť škodlivý zápal [15,74] premenou prozápalového M1-fenotypu na prospešný protizápalový M2-fenotyp [15] a potenciálne podporou neuroprotektívneho mikrogliálneho fenotypu [15,17,74,163,166]. Úlohu prozápalových/protizápalových cytokínov pri psychiatrických poruchách podporuje niekoľko dôkazov (obrázok 1, tabuľka 2) [15,17,29,52,74].
V prípade MDD najnovšia metaanalýza (29 štúdií, 822 MDD, 726 zdravých kontrol) sérových prozápalových cytokínov potvrdila, že rozpustný IL-2 receptor, IL-6 a TNF-? hladiny sú zvýšené v MDD (trait markers) [91], zatiaľ čo IL-1p, IL-2, IL-4, IL-8 a IL-10 sa štatisticky nelíšia od kontrol [91]. V primárnej cytokínovej štúdii porovnávajúcej MDD podskupiny (47 samovražedných MDD, 17 nesuicidálnych MDD, 16 zdravotných kontrol), sérový IL-6 aj TNF-? boli signifikantne vyššie, zatiaľ čo hladiny IL-2 boli signifikantne nižšie u jedincov s MDD, ktorí spáchali samovraždu v porovnaní s oboma ďalšími skupinami [96]. Toto zistenie naznačuje, že IL-6 a TNF-? sú tiež stavovými markermi MDD [96]. Zníženie hladín IL-2 v sére spojené s akútnym samovražedným správaním môže odrážať zvýšenú väzbu na jeho upregulovaný receptor v mozgu; paralelne s vyššie uvedenou metaanalýzou, ktorá ukazuje zvýšený rozpustný IL-2 receptor v MDD [91]. Štúdie skúmajúce klinický význam cytokínov pri MDD ukázali, že hladiny cytokínov v sére sú zvýšené počas akútnych depresívnych epizód [171,172] a normalizované po úspešnej, ale nie neúspešnej liečbe antidepresívami [17] a elektrokonvulzívnej liečbe [29]; tieto zistenia naznačujú možnú patogénnu úlohu cytokínov.
V BPD boli zmeny sérových cytokínov zhrnuté v nedávnom prehľade; TNF-a, IL-6 a IL-8 sú zvýšené počas manických a depresívnych fáz, zatiaľ čo IL-2, IL-4 a IL-6 sú zvýšené počas mánie [92]. Iné štúdie ukázali, že sérový IL-1? a hladiny IL-1 receptora sa štatisticky nelíšia od zdravých kontrol [92], hoci tkanivové štúdie dokumentovali zvýšené hladiny IL-1? a IL-1 receptor vo frontálnom kortexe BPD [69].
Pri schizofrénii sú výsledky štúdií skúmajúcich abnormality cytokínov protichodné (tabuľka 2). Zatiaľ čo niektoré štúdie zistili zníženie sérových prozápalových cytokínov (IL-2, IFN-?), ako aj zvýšenie sérových a CSF protizápalových cytokínov (IL-10) [52], iné zistili zvýšené sérové pro- a protizápalové cytokíny s dominanciou prozápalového typu [22,173,174 ]. Jedna cytokínová metaanalýza (62 štúdií, 2,298 858 schizofrénie, 1 zdravých kontrol) ukázala zvýšené hladiny antagonistu IL-2R, sIL-6R a IL-174 [52]. Táto štúdia však nezohľadnila použitie antipsychotík, o ktorých sa predpokladá, že zvyšujú produkciu prozápalových cytokínov [40]. Novšia cytokínová metaanalýza (2,572 štúdií, XNUMX XNUMX schizofrenikov,�4,401 12 kontrol), ktoré zodpovedali za antipsychotiká, zistili, že TNF-a, IFN-y, IL-2 a sIL-1R sú konzistentne zvýšené pri chronickej schizofrénii nezávisle od aktivity ochorenia (znakové znaky), zatiaľ čo IL-6p, IL-173 a transformujúci rastový faktor beta pozitívne koreluje s aktivitou ochorenia (stavové markery)[8]. Bunkové kultúry mononukleárnych buniek periférnej krvi (PBMC) získané od schizofrenických pacientov produkovali vyššie hladiny IL-1 a IL-175? spontánne, ako aj po stimulácii LPS, čo naznačuje úlohu aktivovaných monocytov/makrofágov v patológii schizofrénie [XNUMX].
Pri OCD sú výsledky náhodného prieskumu cytokínov v sére a CSF a štúdií PBMC stimulovaných LPS nekonzistentné [93-95,176-179]. Existuje korelácia medzi OCD a funkčným polymorfizmom v oblasti promótora TNF-a. génu [34], hoci štúdie s nízkym výkonom túto asociáciu nepotvrdili [180]. Preto sú zmiešané výsledky zo štúdií dokumentujúcich buď zvýšený alebo znížený TNF-? hladiny cytokínov [93,176-178] môžu odrážať ich variabilné začlenenie podskupiny pacientov s OCD s týmto konkrétnym polymorfizmom v ich kohortách.
Polarizácia cytokínovej odpovede pri veľkej depresii a schizofrénii
Fenotypy cytokínovej odpovede sú klasifikované buď ako prozápalové Th1 (IL-2, IFN-y) alebo protizápalové Th2 (IL-4, IL-5, IL-10) podľa imunitných funkcií, ktoré regulujú. Kým Th1 cytokíny regulujú bunkami sprostredkovanú imunitu namierenú proti intracelulárnym antigénom, Th2 cytokíny regulujú humorálnu imunitu namierenú proti extracelulárnym antigénom [29,52]. Th1 cytokíny sú produkované Th1 lymfocytmi a M1 monocytmi, zatiaľ čo Th2 cytokíny sú produkované Th2 lymfocytmi a M2 monocytmi [29,52]. V mozgu mikroglie vylučujú prevažne Th1 cytokíny, zatiaľ čo astroglie prevažne vylučujú Th2 cytokíny [29,52]. Vzájomný pomer Th1:Th2 cytokínov, ďalej �hojdačka Th1-Th2�, je ovplyvnený podielom aktivovaných mikroglií (nadbytok Th1) k astroglii (nadbytok Th2) a súhrou medzi aktivovanými T bunkami a nadmernými hladinami glutamátu v CNS, o ktorých sme predpokladali. v prospech Th1 odpovede (obrázok 2) [29,163,166].
Nerovnováha Th1-Th2 môže ovplyvniť metabolizmus tryptofánu zmenou jeho enzýmov [21,52], čím sa katabolizmus tryptofánu posunie na kynurenín (KYN) a katabolizmus KYN na jeden z jeho dvoch downstream metabolitov; microglia kyselina chinolínová, ktorá je sprostredkovaná Th1 odpoveďou alebo astrogliálna kyselina kynurénová (KYNA) (obrázok 1), ktorá je sprostredkovaná Th2 odpoveďou [21,29,170].
Enzýmy metabolizmu tryptofánu ovplyvnené húpačkou Th1-Th2 zahŕňajú (obrázok 1): indolamín 2,3-dioxygenázu (IDO) vyjadrenú mikrogliami a astrogliami, enzýmy obmedzujúce rýchlosť, ktoré sprostredkovávajú konverziu tryptofánu na KYN a serotonínu na 5- kyselina hydroxyindoloctová�[21,29]. Kynurenín 3-monooxygenáza (KMO), exprimovaná výlučne mikrogliami, je enzým obmedzujúci rýchlosť, ktorý premieňa KYN na 3-hydroxykynurenín (3-OH-KYN), ktorý sa ďalej metabolizuje na kyselinu chinolínovú [21,29]. Tryptofán-2,3-dioxygenáza (TDO), vyjadrená výlučne astrogliou, je enzým obmedzujúci rýchlosť konverzie�tryptofánu na KYN [21,29]. Kynurenínaminotransferáza (KAT), exprimovaná predovšetkým v astrogliálnych procesoch, je enzým obmedzujúci rýchlosť, ktorý sprostredkováva konverziu KYN na KYNA [21,29].
Th1 cytokíny aktivujú mikrogliálne IDO a KMO, čím posúvajú mikrogliálny katabolizmus KYN smerom k chinolínovým�syntéza kyseliny (NMDAR agonista), zatiaľ čo Th2 cytokíny inaktivujú mikrogliálne IDO a KMO, čím sa astrogliálny katabolizmus KYN posúva smerom k syntéze KYNA (antagonista NMDAR) sprostredkovanej TDO a KAT (obrázok 1) [21,29].
Th1 a Th2 predominantné imunofenotypy boli navrhnuté pre MDD a schizofréniu, v uvedenom poradí, na základe vzorcov periférnych cytokínov, a nie CNS [52,173]. Sme presvedčení, že vzory periférnych cytokínov sú nespoľahlivými náhradnými markermi tých v CNS. Hladiny periférnych cytokínov môžu byť skutočne ovplyvnené mnohými premennými mimo CNS, ktoré nie sú konzistentne kontrolované v niekoľkých štúdiách periférnych cytokínov, vrátane: 1) veku, indexu telesnej hmotnosti, psychotropných liekov, fajčenia, stresu a cirkadiánnych fluktuácií; 2) vplyv�aktivita/stav choroby pri produkcii syntézy vybraných cytokínov [95,173]; a 3) účinky psychotropných látok na produkciu cytokínov [52]. Krátke polčasy a rýchly obrat sérových cytokínov [181] (napríklad 18 minút pre TNF-a [182] oproti 60 minútam pre IL-10 [183]) môžu ďalej obmedziť spoľahlivosť interpretácie ich hladiny merané z náhodného odberu vzoriek séra.
Pri MDD existuje konsenzus, že prevažuje prozápalová Th1 imunofenotypová odpoveď (tabuľka 2) [17,29]. Vysoké hladiny kyseliny chinolínovej v post mortem mozgoch MDD [53] naznačujú prítomnosť upregulovanej Th1 odpovede (obrázok 1) [21,29]. Zvýšená kyselina chinolínová v CNS môže podporovať apoptózu ľudskej astroglie sprostredkovanú prílevom vápnika [184], čo môže hypoteticky otupiť�Th2 odpoveď odvodená z astroglie [29], preklopenie rovnováhy medzi Th1 a Th2 v prospech mikrogliálnej Th1 odpovede. Hyposerotonergia CNS [29] pridáva ďalšiu podporu k nadmernej odpovedi Th1, o ktorej sa ukázalo, že znižuje syntézu serotonínu v CNS [185] a zvyšuje jeho degradáciu (obrázok 1) [21,29].
Hyperglutamatergia CNS môže tiež prispieť k nadmernej Th1 reakcii v mozgu (obrázok 2). Štúdia in vitro naznačuje, že periférne pokojové T lymfocyty konštitutívne exprimujú metabotropný glutamátový receptor 5 (mGluR5) [164], ktorého väzba na glutamát inhibuje uvoľňovanie lymfocytového IL-6, čím sa znižuje proliferácia autoreaktívnych T-efektorových buniek [164]. Aktivované T lymfocyty, ale nie pokojové T lymfocyty, môžu prechádzať cez BBB [37].
Experimentálne údaje naznačujú, že interakcia medzi receptormi T buniek aktivovaných T lymfocytov a ich príbuznými bunkami prezentujúcimi antigén môže downregulovať mGluR5 a indukovať expresiu mGluR1 [164]. Na zvieracích modeloch väzba nadbytočného glutamátu na lymfocytové mGluR1 receptory podporuje produkciu Th1 cytokínov, vrátane IFN-a. [164].
Predpokladáme, že u niektorých pacientov s MDD, súbežne s experimentálnymi údajmi [164], väzba nadbytku glutamátu CNS na indukované lymfocytárne mGluR1 receptory môže prispieť k nadmernej Th1 reakcii, vrátane IFN-? (Obrázok 2). Špekulujeme, že IFN-? v malom množstve, podobne ako jeho in vitro účinky na mikroglie [166], môže indukovať mikrogliálnu expresiu MHC-II a EAAT2 [163,166], čo umožňuje mikrogliám slúžiť ako bunky prezentujúce príbuzný antigén a poskytovať funkciu spätného vychytávania glutamátu [163,164,166], čím sa škodlivé mikroglie transformujú na neuroprotektívny fenotyp [163,166], ktorý sa podieľa na eliminácii nadbytku extracelulárneho glutamátu [163,164,166]. Preto tiež predpokladáme, že nadmerná Th1 odpoveď v podskupinách pacientov s MDD je dvojsečná zbraň, ktorá podporuje škodlivý zápal a slúži ako prospešný protiregulačný mechanizmus, ktorý môže obmedziť nadmernú neuroexcitotoxicitu súvisiacu s glutamátom (obrázok 2).
Zatiaľ čo pri schizofrénii niektoré štúdie periférnych cytokínov naznačujú prevahu protizápalového imunofenotypu/reakcie Th2 [52], iné to vyvracajú [173,174]. Súhlasíme však s autormi, ktorí predpokladali, že Th2 odpoveď je dominantným fenotypom pri schizofrénii [52]. Zvýšené hladiny KYNA v mozgu, CSF a sére [21,52] naznačujú downreguláciu mikrogliálneho IDO a KMO, čo je funkcia Th2 odpovede, ktorá posúva astrogliálny katabolizmus KYN smerom k syntéze KYNA (obrázok 1) [21,52]. Znížená aktivita KMO a expresia KMO mRNA v post mortem schizofrenických mozgoch [73] je v súlade s nadmernou Th2 odpoveďou (obrázok 1). Zvýšená prevalencia abnormalít humorálnej imunity sprostredkovanej Th2 v podskupinách pacientov so schizofréniou�ako to dokazuje zvýšený počet B buniek [21,76], zvýšený�produkcia autoprotilátok vrátane antivírusových protilátok [76] a zvýšeného imunoglobulínu E [52] pridáva ďalšiu podporu hypotéze dominancie Th2 odpovede.
Neurozápal a dysregulácia glutamátu CNS
Glutamát sprostredkúva poznanie a správanie [186]. Hladiny synaptického glutamátu sú regulované vysokoafinitnými gliovými a neurónovými EAAT závislými od sodíka, menovite systémom XAG zodpovedným za spätné vychytávanie glutamátu/uvoľňovanie aspartátu [137,164, 164] a systémom antiporterov astrogliálneho glutamátu/cystínu nezávislým od sodíka (Xc-) zodpovedný za uvoľňovanie glutamátu/spätné vychytávanie cystínu [1]. Astrogliálne EAAT2 a EAAT90 zabezpečujú viac ako 79 % spätného vychytávania glutamátu [XNUMX].
Neurozápal môže zmeniť metabolizmus glutamátu a funkciu jeho transportérov [15,29,187,188], čo spôsobuje kognitívne, behaviorálne a psychiatrické poruchy [15,21,29,79,186,188,189]. Abnormality funkcie/expresie EAAT a metabolizmu glutamátu pri MDD, BPD, schizofrénii a OCD sú zhrnuté v tabuľke 2.
Pri MDD existujú dôkazy o kortikálnej hyperglutamatergii (tabuľka 2). Hladiny kortikálneho glutamátu pozitívne korelovali so závažnosťou symptómov depresie a päťtýždňová liečba antidepresívami znížila koncentrácie glutamátu v sére [85,86]. Jedna dávka ketamínu, silného antagonistu NMDAR, môže zvrátiť refraktérnu MDD na týždeň [17,21,29,85]. Nadmerné hladiny glutamátu v CNS môžu vyvolať zápal sprostredkovaný neurotoxicitou [163,164,188, 1, 2] vrátane prozápalovej Th164 odpovede (obrázok XNUMX) [XNUMX].
Obmedzené in vitro dôkazy naznačujú, že zápalové/prozápalové cytokíny môžu zvýšiť hladiny glutamátu v CNS [188] v doprednom cykle prostredníctvom niekoľkých potenciálnych mechanizmov: 1) prozápalové cytokíny môžu inhibovať [15,17,168] a zvrátiť [45,137] astrogliálny glutamát sprostredkovaný EAAT funkcia spätného vychytávania; 2) prozápalové cytokíny môžu zvýšiť syntézu mikrogliálnej kyseliny chinolínovej [53], o ktorej sa experimentálne ukázalo, že podporuje uvoľňovanie synaptozomálneho glutamátu [15,17,29,190]; 3) zvýšené COX-2/PGE-2 a TNF-? hladiny môžu vyvolať influx vápnika [137], ktorý na základe údajov in vitro môže zvýšiť uvoľňovanie astrogliálneho glutamátu a D-serínu [191]; a 4) aktivované mikroglie môžu exprimovať prebytok Xc-antiporterových systémov, ktoré sprostredkovávajú uvoľňovanie glutamátu [164,192, XNUMX].
Pri schizofrénii sa nachádza prefrontálna kortikálna hypoglutamatergia [87,90,193,194] (tabuľka 2) a znížená funkčnosť NMDAR [5]. Nedávna metaanalýza H1 magnetickej rezonančnej spektroskopie (MRS) (28 štúdií, 647 schizofrénie, 608 kontrola) potvrdila znížené hladiny glutamátu a zvýšené hladiny glutamínu v mediálnom frontálnom kortexe [90]. Úloha zápalu k hypoglutamatergii nie je dokázaná. Zvýšená syntéza KYNA v mozgoch schizofrénie [21,52], typicky funkcia Th2 odpovede (obrázok 1), môže inhibovať NR1 podjednotku NMDAR a alfa 7 nikotínovú�acetylcholínový receptor (a7nAchR) [195], čo vedie k zníženiu funkcie NMDAR a zníženiu uvoľňovania glutamátu sprostredkovaného a7nAchR [195].
Pri BPD a OCD údaje naznačujú kortikálnu hyperglutamatergiu CNS pri oboch poruchách (tabuľka 2) [78,84,88,131]. Príspevok zápalu (BPD a OCD) a autoprotilátok (OCD)[7,77,84,88,130] k zvýšeným hladinám glutamátu v CNS si vyžaduje ďalšie skúmanie.
Úloha S100B
S100B je 10 kDa proteín viažuci vápnik produkovaný astrogliou, oligodendrogliou a ependymálnymi bunkami choroidálneho plexu [196]. Sprostredkúva svoje účinky na okolité neuróny a gliu prostredníctvom receptora pre konečný produkt pokročilej glykácie [196]. Nanomolárne extracelulárne hladiny S100B poskytujú priaznivé neurotrofické účinky, obmedzujú poškodenie neurónov súvisiace so stresom, inhibujú mikrogliálny TNF-? uvoľnenie a zvýšenie spätného vychytávania astrogliálneho glutamátu [196]. Mikromolárne koncentrácie S100B, prevažne produkované aktivovanými astrogliami a lymfocytmi [196,197], majú škodlivé účinky prenášané receptorom pre konečný produkt pokročilej glykácie, ktorý zahŕňa apoptózu neurónov, produkciu COX-2/PGE-2, IL-1? a indukovateľné druhy oxidu dusnatého a upregulácia monocytového/mikrogliálneho TNF-a. sekrécie [21,196,198].
Hladiny S100B v sére a najmä v CSF a mozgovom tkanive sú indikátormi gliálnej (prevažne astrogliálnej) aktivácie [199]. Pri MDD a psychóze hladiny S100B v sére pozitívne korelujú so závažnosťou suicidality, nezávisle od psychiatrickej diagnózy [200]. Postmortálna analýza S100B ukázala znížené hladiny MDD a BPD v dorzolaterálnom prefrontálnom kortexe a zvýšené hladiny BPD v parietálnom kortexe [196].
Metaanalýza (193 porúch nálady, 132 zdravých kontrol) potvrdila zvýšené hladiny S100B v sére a CSF pri poruchách nálady, najmä počas akútnych depresívnych epizód a mánie [201].
Pri schizofrénii sú hladiny S100B v mozgu, CSF a sére zvýšené [199,202, 12]. Metaanalýza (380 štúdií, 358 schizofrénie, 100 zdravých kontrol) potvrdila zvýšené sérové hladiny S203B pri schizofrénii [100]. V postmortálnych mozgoch pacientov so schizofréniou sa imunoreaktívne astroglie S154B nachádzajú v oblastiach podieľajúcich sa na schizofrénii, vrátane predného cingulárneho kortexu, dorzolaterálneho prefrontálneho kortexu, orbitofrontálneho kortexu a hipokampov [100]. Zvýšené hladiny S154B korelujú s paranoidnou [204] a negativistickou psychózou [202], zhoršenou kogníciou, zlou terapeutickou odpoveďou a trvaním choroby [100]. Genetické polymorfizmy v S32B [2] a receptor pre gény koncových produktov pokročilej glykácie v kohortách schizofrénie (tabuľka 32,33,205) [100] naznačujú, že tieto abnormality sú pravdepodobne skôr primárne/patogénne než sekundárne/biomarkery. Pokles hladín S201B v sére po liečbe antidepresívami [196] a antipsychotikami [XNUMX] skutočne naznačuje�určitý klinický význam S100B pre patofyziológiu psychiatrických porúch.
Neurozápal a zvýšený oxidačný stres
Oxidačný stres je stav, pri ktorom nadbytok oxidantov poškodzuje alebo modifikuje biologické makromolekuly, ako sú lipidy, proteíny a DNA [206-209]. Tento nadbytok je výsledkom zvýšenej produkcie oxidantov, zníženej eliminácie oxidantov, defektnej antioxidačnej obrany alebo nejakej ich kombinácie [206-209]. Mozog je obzvlášť citlivý na oxidačný stres v dôsledku: 1) zvýšených množstiev peroxidovateľných polynenasýtených mastných kyselín; 2) relatívne vysoký obsah stopových minerálov, ktoré indukujú peroxidáciu lipidov a kyslíkové radikály (napríklad železo, meď); 3) vysoká spotreba kyslíka; a 3) obmedzené antioxidačné mechanizmy [206,207, XNUMX].
Nadmerný oxidačný stres sa môže vyskytnúť pri MDD [206], BPD [206,207, 207,209], schizofrénii [206,208, 4] a OCD [2, 206,207]. Medzi periférne markery oxidačných porúch patria zvýšené produkty peroxidácie lipidov (napríklad malondialdehyd a XNUMX-hydroxy-XNUMX-nonenal), zvýšené metabolity oxidu dusnatého (NO), znížené hladiny antioxidantov (napríklad glutatión) a zmenené hladiny antioxidačných enzýmov [XNUMX].
Pri MDD zvýšená produkcia aniónov superoxidových radikálov koreluje so zvýšenou apoptózou neutrofilov sprostredkovanou oxidáciou [206]. Sérové hladiny antioxidačných enzýmov (napríklad superoxiddismutázy-1) sú zvýšené počas akútnych depresívnych epizód a normalizujú sa po liečbe selektívnymi inhibítormi spätného vychytávania serotonínu (SSRI) [206]. To naznačuje, že pri MDD sú hladiny antioxidačných enzýmov v sére stavovým markerom, ktorý môže odrážať kompenzačný mechanizmus, ktorý pôsobí proti akútnemu zvýšeniu oxidačného stresu. [206]. Naproti tomu pri schizofrénii sú hladiny rozpustnej superoxiddismutázy-1 v CSF podstatne znížené u schizofrenických pacientov so skorým nástupom v porovnaní s chronickými schizofrenickými pacientmi a zdravými kontrolami. To naznačuje, že znížené hladiny antioxidačných enzýmov v mozgu môžu prispieť k oxidačnému poškodeniu pri akútnej schizofrénii [210], hoci na potvrdenie tohto zistenia sú potrebné rozsiahlejšie štúdie.
Niekoľko ďalších experimentálnych a humánnych štúdií podrobnejšie skúmalo mechanizmy, ktoré sú základom patofyziológie zvýšeného oxidačného stresu pri psychiatrických poruchách [206-262]. Na zvieracích modeloch depresie sú hladiny glutatiónu v mozgu znížené, zatiaľ čo peroxidácia lipidov a hladiny NO sú zvýšené (206,262, XNUMX).
Postmortálne štúdie ukazujú znížené hladiny celkového glutatiónu v mozgu u MDD, BPD [206] a schizofrenických jedincov [206,207, 262]. Fibroblasty kultivované od pacientov s MDD vykazujú zvýšený oxidačný stres nezávislý od hladín glutatiónu [XNUMX], čo argumentuje proti primárnej úlohe deplécie glutatiónu ako hlavného mechanizmu oxidačného stresu pri depresii.
Mikrogliálna aktivácia môže zvýšiť oxidačný stres produkciou prozápalových cytokínov a NO [206-209]. Prozápalové cytokíny a vysoké hladiny NO môžu podporovať tvorbu reaktívnych foriem kyslíka (ROS), čo zase urýchľuje peroxidáciu lipidov, poškodzuje membránové fosfolipidy a ich membránové monoamínové neurotransmiterové receptory a vyčerpáva endogénne antioxidanty. Zvýšené množstvo produktov ROS môže zvýšiť mikrogliálnu aktiváciu a zvýšiť prozápalovú produkciu prostredníctvom stimulácie NF-?B [208], čo následne udržiava oxidačné poškodenie [208], čím vzniká potenciál pre patologickú slučku pozitívnej spätnej väzby pri niektorých psychiatrických poruchách [206-209]. Hoci neurozápal môže zvýšiť hladiny glutamátu v mozgu [85,86], úloha glutamátergickej hyperaktivity ako príčiny oxidačného stresu zostáva nepodložená [207].
Mitochondriálna dysfunkcia môže prispieť k zvýšenému oxidačnému stresu pri MDD, BPD a schizofrénii [206]. Postmortálne štúdie týchto porúch odhaľujú abnormality v mitochondriálnej DNA, čo je v súlade s vysokou prevalenciou psychiatrických porúch pri primárnych mitochondriálnych poruchách [206]. In vitro štúdie na zvieratách ukazujú, že prozápalové cytokíny, ako je TNF-a, môžu znížiť mitochondriálnu hustotu a zhoršiť mitochondriálny oxidačný metabolizmus [211,212, 206,213], čo vedie k zvýšenej produkcii ROS [206,213, XNUMX]. Tieto experimentálne zistenia môžu naznačovať mechanické väzby medzi neurozápalom, mitochondriálnou dysfunkciou a oxidačným stresom [XNUMX, XNUMX], čo si zaslúži ďalšie skúmanie týchto pretínajúcich sa patogénnych dráh u ľudských psychiatrických porúch.
Zraniteľnosť nervového tkaniva voči oxidačnému poškodeniu sa líši medzi rôznymi psychiatrickými poruchami na základe neuroanatomických, neurochemických a molekulárnych dráh zapojených do špecifickej poruchy [207]. Účinky liečby môžu byť tiež kritické, keďže predbežné dôkazy naznačujú, že antipsychotiká, SSRI a stabilizátory nálady majú antioxidačné vlastnosti [206,207,262]. Terapeutická úloha adjuvantných antioxidantov (napríklad vitamínov C a E) pri psychiatrických poruchách musí byť podložená výkonnými randomizovanými klinickými štúdiami. N-acetylcysteín vykazuje doteraz najsľubnejšie výsledky, pričom niekoľko randomizovaných placebom kontrolovaných štúdií demonštrovalo jeho účinnosť pri MDD, BPD a schizofrénii [207].
Dysfunkcia krvo-mozgovej bariéry
BBB zabezpečuje imunitne privilegovaný stav mozgu obmedzením vstupu periférnych zápalových mediátorov vrátane cytokínov a protilátok, ktoré môžu zhoršiť neurotransmisiu [214,215, 60,214,216,217]. Hypotéza rozpadu BBB a jeho úloha u niektorých psychiatrických pacientov [97] je v súlade so zvýšenou prevalenciou psychiatrickej komorbidity pri ochoreniach spojených s jeho dysfunkciou, vrátane SLE [11], mozgovej príhody [XNUMX],�epilepsia [218] a autoimunitné encefalitídy (tabuľka 1). Zvýšený pomer CSF:sérový albumín u pacientov s MDD a schizofréniou naznačuje zvýšenú permeabilitu BBB (214).
V jednej štúdii (63 psychiatrických pacientov, 4,100 41 kontrol) boli abnormality CSF svedčiace o poškodení BBB zistené u 14 % psychiatrických pacientov (14 MDD a BPD, 5 schizofrénia), vrátane intratekálnej syntézy IgG, IgM a/alebo IgA, mierna pleocytóza CSF (8 až 3 buniek na mm216) a prítomnosť až štyroch IgG oligoklonálnych pásov [60]. Jedna postmortálna ultraštrukturálna štúdia schizofrénie odhalila ultraštrukturálne abnormality BBB v prefrontálnej a zrakovej kôre, ktoré zahŕňali vakuolárnu degeneráciu endotelových buniek, astrogliálne výbežky na konci nohy a zhrubnutie a nepravidelnosť bazálnej laminy [217]. V tejto štúdii sa však autori nevyjadrili k potenciálnemu prínosu postmortálnych zmien k ich zisteniam. Ďalšia štúdia skúmajúca transkriptomiku endotelových buniek BBB v schizofrenických mozgoch identifikovala významné rozdiely medzi génmi ovplyvňujúcimi imunologickú funkciu, ktoré neboli zistené u kontrol [XNUMX].
Endoteliálna dysfunkcia sprostredkovaná oxidáciou môže prispieť k patofyziológii dysfunkcie BBB pri psychiatrických poruchách. Nepriame dôkazy z klinických a experimentálnych štúdií pri depresii (219) a v menšej miere pri schizofrénii (220) naznačujú, že zvýšená oxidácia môže prispievať k endoteliálnej dysfunkcii. Endoteliálna dysfunkcia môže predstavovať spoločný mechanizmus zodpovedný za známu súvislosť medzi depresiou a kardiovaskulárnym ochorením [219,221, 221], čo môže súvisieť so zníženými hladinami vazodilatačného NO [223 – 4]. Experimentálne štúdie naznačujú, že znížené hladiny endotelového NO sú mechanicky spojené s odpojením endotelovej syntázy oxidu dusnatého (eNOS) od jej esenciálneho kofaktora tetrahydrobiopterínu (BH224), čím sa jej substrát posúva z L-arginínu na kyslík [226-227]. Neviazaný eNOS podporuje syntézu ROS (napríklad superoxidu) a reaktívnych foriem dusíka (RNS) (napríklad peroxydusitan; produkt interakcie superoxidu s NO) [224] namiesto NO, čo vedie k oxidačne sprostredkovanej endoteliálnej dysfunkcii [ 226-XNUMX].
Údaje na zvieratách ukázali, že SSRI môžu obnoviť nedostatočnú hladinu endotelového NO [219], čo naznačuje, že antioxidačné mechanizmy môžu prispievať k ich antidepresívnym účinkom. U ľudí môže L-metylfolát zosilniť antidepresívne účinky SSRI [228], údajne zvýšením hladín BH4, ktorý je základným kofaktorom pre antioxidačnú reakciu sprostredkovanú eNOS opätovným spojením [229], ako aj pre rýchlosť -obmedzujúce enzýmy syntézy monoamínov (t.j. serotonínu, noradrenalínu, dopamínu) [228].
Súhrnne povedané, nedávna práca zdôrazňujúca úlohu nespojeného oxidačného stresu indukovaného eNOS v patogenéze vaskulárnych ochorení [230,231, XNUMX] a�epidemiologické štúdie, ktoré ustanovujú depresiu ako nezávislý rizikový faktor vaskulárnych patológií, ako je mŕtvica a srdcové choroby [219,221, 212], pridávajú ďalšiu podporu klinickej relevancii nesúvisiaceho eNOS-sprostredkovaného endotelového oxidačného poškodenia pri depresii. Napriek mnohým dôkazom o cytokínových abnormalitách pri ľudských psychiatrických ochoreniach a experimentálnym údajom, ktoré ukazujú, že prozápalové cytokíny môžu znížiť expresiu eNOS [215] a zvýšiť permeabilitu BBB [XNUMX], existujú ľudské dôkazy, ktoré priamo spájajú nadbytok prozápalových cytokínov s dysfunkciou eNOS a/alebo poruchou BBB. chýba.
Zobrazovanie a liečba zápalov pri psychiatrických ochoreniach
Zobrazovanie Neuroinflammation In situ
Klinicky sa zobrazovanie neurozápalov môže ukázať ako kľúčové pre identifikáciu podskupiny psychiatrických pacientov s neurozápalom, ktorí by s najväčšou pravdepodobnosťou reagovali priaznivo na imunomodulačné terapie. Okrem toho takéto zobrazovanie môže lekárom umožniť monitorovať aktivitu ochorenia súvisiaceho s neurozápalom a jeho reakciu na imunitnú terapiu u psychiatrických pacientov. Zobrazovanie zápalu v ľudskom mozgu tradične záviselo od MRI alebo CT vizualizácie extravagovaných intravenóznych kontrastných látok, čo naznačuje lokalizovaný rozpad BBB. MRI s gadolíniom príležitostne demonštruje takýto rozpad v limbických oblastiach spojený s emočným spracovaním u pacientov s psychiatrickými poruchami, ktoré možno pripísať paraneoplastickej alebo inej encefalitíde [107,109,113]. Podľa našich vedomostí sa však abnormálne zlepšenie nikdy nepreukázalo pri žiadnej klasickej psychiatrickej poruche [21,214,232], a to napriek funkčným [214,216] a ultraštrukturálnym abnormalitám BBB [60].
Nie je známe, či je možné in vivo vizualizovať jemný neurozápal pri klasických psychiatrických poruchách. Jednou sľubnou technikou je pozitrónová emisná tomografia (PET) využívajúca rádioaktívne indikátory, ako je C11-PK11195, ktoré sa viažu na translokačný proteín, predtým známy ako periférny benzodiazepínový receptor, exprimovaný aktivovanými mikrogliami [233,234].
Použitím tejto metódy sa ukázalo, že pacienti so schizofréniou majú väčšiu mikrogliálnu aktiváciu v celom kortexe [235] a v hipokampe počas akútnej psychózy [236]. Jedna štúdia (14 schizofrénie, 14 kontrol) nezistila žiadny významný rozdiel medzi väzbou [11C] DAA1106 pri schizofrénii oproti kontrolám, ale priamu koreláciu medzi väzbou [11C] DAA1106 a závažnosťou pozitívnych symptómov a trvaním ochorenia pri schizofrénii [236].
Výskumníci z našej inštitúcie použili C11-PK11195 PET na preukázanie zápalu bi-hipokampu u pacienta s neuropsychiatrickou dysfunkciou vrátane psychotickej MDD, epilepsie a anterográdnej amnézie spojenej s protilátkami anti-GAD [237]. Avšak PK11195 PET má�nízke vlastnosti signálu k šumu a vyžaduje cyklotrón na mieste.
V súlade s tým sa výskum venuje vývoju zlepšených translokačných proteínových ligandov pre PET a SPECT. Budúce vysoko výkonné postmortálne štúdie mozgového tkaniva využívajúce kvantifikáciu proteínov zameranú na objasnenie metabolických a zápalových dráh, cytokínov CNS a ich väzbových receptorov pri psychiatrických poruchách, sú potrebné na to, aby sme porozumeli autoimunitnej patofyziológii.
Úloha protizápalových liekov pri psychických poruchách
Niekoľko štúdií na ľuďoch a zvieratách naznačuje, že určité protizápalové lieky môžu hrať dôležitú doplnkovú úlohu pri liečbe psychiatrických porúch (tabuľka 3). Bežné lieky sú inhibítory cyklooxygenázy (tabuľka 3) [238-245], minocyklín (tabuľka 3) [240-245], omega-3 mastné kyseliny [246,247, 248] a neurosteroidy [XNUMX].
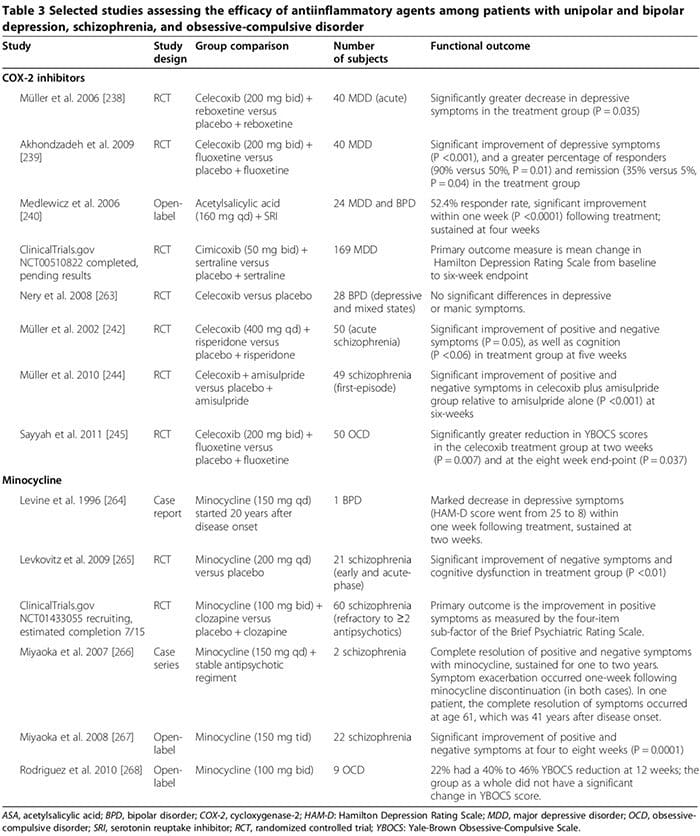 Niekoľko štúdií na ľuďoch ukázalo, že inhibítory COX-2 by mohli zlepšiť psychiatrické symptómy MDD, BPD, schizofrénie a OCD (tabuľka 3) [248]. Naproti tomu prídavná liečba neselektívnymi inhibítormi COX (t. j. nesteroidnými protizápalovými liekmi (NSAID)) môže znížiť účinnosť SSRI [249,250, 2]; dve veľké štúdie uviedli, že expozícia NSAID (ale nie selektívnym inhibítorom COX-249,250 ani salicylátom) bola spojená s významným zhoršením depresie u podskupiny účastníkov štúdie [XNUMX].
Niekoľko štúdií na ľuďoch ukázalo, že inhibítory COX-2 by mohli zlepšiť psychiatrické symptómy MDD, BPD, schizofrénie a OCD (tabuľka 3) [248]. Naproti tomu prídavná liečba neselektívnymi inhibítormi COX (t. j. nesteroidnými protizápalovými liekmi (NSAID)) môže znížiť účinnosť SSRI [249,250, 2]; dve veľké štúdie uviedli, že expozícia NSAID (ale nie selektívnym inhibítorom COX-249,250 ani salicylátom) bola spojená s významným zhoršením depresie u podskupiny účastníkov štúdie [XNUMX].
V prvej štúdii zahŕňajúcej 1,258 12 pacientov s depresiou liečených citalopramom počas 45 týždňov bola miera remisie významne nižšia medzi tými, ktorí užili NSAID aspoň raz v porovnaní s tými, ktorí ich neužívali (55 % oproti 0.64 %, OR 0.0002, P = 249) [1,545]. Ďalšia štúdia zahŕňajúca 1.55 95 jedincov s MDD ukázala, že miera depresie rezistentnej na liečbu bola signifikantne vyššia u tých, ktorí užívali NSAID (ALEBO 1.21, 2.00 % CI 231 až 10,12) [18]. Zhoršenie depresie v skupinách NSAID nemusí byť mechanicky spojené s liečbou NSAID, ale môže súvisieť s koexistujúcimi chronickými zdravotnými stavmi [249,251-XNUMX], ktoré si vyžadujú dlhodobé užívanie NSAID a o ktorých je známe, že sú nezávisle spojené s zvýšené riziko depresie rezistentnej na liečbu [XNUMX]. Sú potrebné budúce štúdie skúmajúce vplyv NSAID na depresiu a reakciu na antidepresíva u ľudí.
V iných experimentálnych štúdiách využívajúcich paradigmy akútneho stresu na vyvolanie stavu podobného depresii u myší citalopram zvýšil TNF-a, IFN-a a p11 (molekulárny faktor spojený s depresívnym správaním u zvierat) vo frontálnom kortexe, zatiaľ čo NSAID ibuprofén znížil tieto molekuly; NSAID tiež oslabili antidepresívne účinky SSRI, ale nie iných antidepresív (249). Tieto zistenia naznačujú, že prozápalové cytokíny môžu paradoxne prejavovať antidepresívne účinky napriek drvivým dôkazom z�štúdie na ľuďoch naopak (ako je uvedené vyššie), ktoré môžu byť oslabené NSAID [249]. Tento zdanlivý paradox môžu vysvetliť aspoň dve úvahy: 1) za niektorých experimentálnych podmienok boli prozápalové cytokíny spojené s neuroprotektívnou úlohou [251; (pre�napríklad IFN-? v nízkych hladinách môže vyvolať neuroprotektívne mikroglie (obrázok 2) [163,166,251]); a 2) či sú tieto reakcie pozorované v kontexte paradigmy akútneho stresu na zvieracom modeli aplikovateľné na endogénnu MDD u ľudí, zostáva nejasné [251].
Terapeutické účinky inhibítorov COX-2 pri psychiatrických poruchách môžu zahŕňať moduláciu biosyntézy prostaglandínov odvodených od COX-2, vrátane prozápalového PGE2 a protizápalového 15-deoxy-a12,14-PGJ2 (15d-PGJ2) [252,253]. Inhibítory COX-2 môžu znížiť zápal sprostredkovaný PGE2, čo môže prispieť k patofyziológii psychiatrických porúch [252,253, 15]. Môžu tiež meniť hladiny 2d-PGJ252,253 a aktivitu jeho jadrového receptora gama aktivovaného peroxizómovým proliferátorom (PPAR-y) [XNUMX, XNUMX].
Niekoľko štúdií naznačuje, že 15d-PGJ2 a jeho jadrový receptor PPAR-? môžu slúžiť ako biologické markery schizofrénie (253). U schizofrenických pacientov sú hladiny PGE2 v sére zvýšené, zatiaľ čo hladiny 15d-PGJ2 v sére sú znížené, rovnako ako expresia jeho jadrového receptora PPAR-? v PBMC [252]. Zatiaľ čo inhibítory COX-2 môžu obmedziť potenciálne prospešné protizápalové účinky COX-2�dependentného �15d-PGJ2/PPAR-? cestu� môžu výhodne znížiť jeho škodlivé účinky, vrátane 1) zvýšeného rizika infarktu myokardu a určitých infekcií (napríklad cytomegalovírus a Toxoplasma gondii) u schizofrenických pacientov [254] a 2) jeho proapoptotické účinky pozorované u ľudské a zvieracie rakovinové tkanivo [255]. Ďalšie potenciálne mechanizmy terapeutických účinkov inhibítorov COX-2 môžu zahŕňať ich schopnosť znižovať hladiny prozápalových cytokínov [163], obmedzovať excitotoxicitu kyseliny chinolínovej (ako pri MDD) a znižovať hladiny KYNA (ako pri schizofrénii) [128].
Minocyklín môže byť účinný pri psychiatrických poruchách (tabuľka 3) [248]. Údaje in vitro naznačujú, že minocyklín inhibuje MAP, sekréciu cytokínov, expresiu COX-2/PGE-2 a indukovateľnú syntázu oxidu dusnatého [256]. Minocyklín môže tiež pôsobiť proti dysregulovanej glutamátergickej a dopamínergnej neurotransmisii (256).
Účinnosť omega-3 mastných kyselín pri psychiatrických poruchách je nejasná (248). V metaanalýze 2011 randomizovaných kontrolovaných štúdií z roku 15 (916 MDD) doplnky omega-3 obsahujúce kyselinu eikozapentaénovú o ≥ 60 % (rozsah dávky 200 až 2,200 0.001 mg/deň prevyšujúce dávku kyseliny dokosahexaénovej) významne znížili symptómy depresie. prídavná liečba k SRI (P < 246) [3]. Následná metaanalýza však dospela k záveru, že neexistuje žiadny významný prínos omega-247 mastných kyselín pri depresii a že údajná účinnosť je len výsledkom skreslenia publikácie [2012]. Metaanalýza 5 randomizovaných kontrolovaných štúdií z roku 291 vrátane 3 účastníkov BPD zistila, že depresívne, ale nie manické symptómy sa významne zlepšili u tých, ktorí boli randomizovaní na omega-0.34 mastné kyseliny v porovnaní s tými, ktorí užívali placebo (Hedges g 0.025, P = 257) [12]. V randomizovanej kontrolovanej štúdii u schizofrenických subjektov sledovaných do 66 mesiacov sa skóre pozitívnych aj negatívnych symptómov významne znížilo u 3 účastníkov randomizovaných na omega-1.2 s dlhým reťazcom (12 g/deň počas 0.02 týždňov; P = 0.01 a 258, v uvedenom poradí) [XNUMX]; �autori dospeli k záveru, že augmentácia omega-3 počas skorého priebehu schizofrénie môže tiež zabrániť relapsom a progresii ochorenia (258).
Metaanalýza siedmich randomizovaných kontrolovaných štúdií z roku 2012 hodnotiacich augmentáciu omega-3 u 168 schizofrenických pacientov nezistila žiadny prínos liečby [259]. Autori tejto metaanalýzy konkrétne uviedli, že nie je možné vyvodiť žiadny záver týkajúci sa cieľových ukazovateľov prevencie relapsu alebo progresie ochorenia [259]. Experimentálne údaje naznačujú, že kyselina eikozapentaénová a kyselina dokosahexaénová sprostredkovávajú svoje protizápalové účinky podporou syntézy resolvínov a protektínov, ktoré môžu inhibovať infiltráciu leukocytov a znižovať produkciu cytokínov [248].
Neurosteroidy vrátane pregnenolónu a jeho následného metabolitu alopregnanolónu môžu mať priaznivú úlohu pri niektorých psychiatrických poruchách (248,260, 261). Pri MDD niekoľko štúdií zistilo znížené hladiny alopregnanolónu v plazme/CSF korelujúce so závažnosťou symptómov, ktoré sa normalizovali po úspešnej liečbe určitými antidepresívami (napríklad SSRI) a elektrokonvulzívnej liečbe (248). Pri schizofrénii môžu byť hladiny pregnenolónu v mozgu zmenené [260] a hladiny alopregnanolónu v sére sa môžu zvýšiť po niektorých antipsychotikách (napríklad klozapín a olanzapín) (100). V troch randomizovaných kontrolovaných štúdiách (248 schizofrénie (spolu); dĺžka liečby približne deväť týždňov) sa pozitívne, negatívne a kognitívne symptómy, ako aj extrapyramídové vedľajšie účinky antipsychotik významne zlepšili v jednej alebo viacerých štúdiách medzi randomizovanými pregnenolón v porovnaní s tými, ktorí dostávali placebo (248). V jednej štúdii sa zlepšenie udržalo pri dlhodobej liečbe pregnenolónom (248). Pregnenolón môže regulovať kogníciu a správanie zosilnením funkcie NMDA a GABAA receptorov [248]. Okrem toho môže alopregnanolón vykazovať neuroprotektívne a protizápalové účinky (XNUMX). Na potvrdenie prospešnej úlohy neuroaktívnych steroidov pri včasnom nástupe psychiatrických porúch u ľudí je potrebných viac štúdií RCT.
Čakáme na výsledky niekoľkých prebiehajúcich klinických štúdií skúmajúcich terapeutické účinky iných protizápalových činidiel, vrátane salicylátu, inhibítora NF-kB (NCT01182727); kyselina acetylsalicylová (NCT01320982); pravastatín (NCT1082588); a dextrometorfan, nekompetitívny antagonista NMDAR, ktorý môže obmedziť zápalom indukované dopamínergné poškodenie neurónov (NCT01189006).
Budúce liečebné stratégie
Hoci súčasné imunitné terapie (napríklad IVIG, plazmaferéza, kortikosteroidy a imunosupresíva) sú často účinné pri liečbe autoimunitných encefalitíd, pri ktorých je zápal akútny, intenzívny a prevažne adaptívneho pôvodu, ich účinnosť je účinná pri klasických psychiatrických poruchách, pri ktorých je zápal chronický,�oveľa miernejšia a prevažne vrodeného pôvodu je obmedzená [2]. Vývoj nových terapeutík by sa mal zamerať skôr na zvrátenie straty glií [46,138], down-reguláciu škodlivého MAP a zároveň na optimalizáciu endogénnych neuroprotektívnych T regs a prospešných MAP, než na nerozlišujúce potláčanie zápalu, ku ktorému dochádza pri súčasných imunosupresívach. Okrem toho je potrebný vývoj účinných koadjuvantných antioxidantov, ktoré by zvrátili oxidačné poškodenie pri psychiatrických poruchách.
Závery
Autoimunita môže spôsobiť množstvo neuropsychiatrických porúch, ktoré sa môžu spočiatku prejavovať izolovanými psychiatrickými symptómami. Vrodený zápal/autoimunita môže byť relevantná pre patogenézu psychiatrických symptómov u podskupiny pacientov s klasickými psychiatrickými poruchami. Vrodený zápal môže byť mechanicky spojený s tradičnými monoaminergnými a glutamátergnými abnormalitami a zvýšeným oxidačným poškodením hláseným pri psychiatrických ochoreniach.
Souhel Najjar1,5*, Daniel M Pearlman2,5, Kenneth Alper4, Amanda Najjar3 a Orrin Devinsky1,4,5
Skratky
3-OH-KYN: 3-hydroxy-kynurenín; a7nAchR: alfa 7 nikotínové acetylcholínové receptory; AMPAR: receptory kyseliny amino-3-hydroxy-5-metyl-4-XNUMX-izoxazolpropiónovej; APC: antigén prezentujúca bunka; BBB: hematoencefalická bariéra;
BH4: tetrahydrobiopterín; BPD: bipolárna porucha; CI: interval spoľahlivosti;
CNS: Centrálny nervový systém; COX-2: cyklooxegenáza-2; CSF: cerebrospinálny mok; DSM-IV: Diagnostic and Statistical Manual of Mental Disorders 4th Edition; EAAT: transportéry excitačných aminokyselín; eNOS: endoteliálna syntáza oxidu dusnatého; GABAB: kyselina gama-aminomaslová-beta; GAD: dekarboxyláza kyseliny glutámovej; GFAP: gliový fibrilárny kyslý proteín; GLX: 1H MRS detegovateľný glutamát, glutamín, kompozit kyseliny gama-aminomaslovej;
IDO: indolamín 2,3-dioxygenáza; Ig: imunoglobulín; IL: interleukín; IL-1RA: antagonista receptora interleukínu 1; IFN-y: interferón gama;
KAT: kynurenín aminotransferáza; KMO: kynurenín 3-monooxygenáza; KYN: kynurenín; KYNA: kyselina kynurénová; LE: limbická encefalitída;
LPS: lipopolysacharid; MAP: mikrogliálna aktivácia a proliferácia;
MDD: Veľká depresívna porucha; mGluR: Metabotropný glutamátový receptor; MHC: II hlavný histokompatibilný komplex triedy dva; MRI: Zobrazovanie magnetickou rezonanciou; MRS: Magnetická rezonančná spektroskopia; NF-kB: jadrový faktor kapa B; NMDAR: N-metyl-D-aspartátový receptor; NR1: glycínové miesto;
OCD: obsedantno-kompulzívna porucha; ALEBO: pomer šancí; PANDAS: Pediatrické neuropsychiatrické autoimunitné poruchy spojené so streptokokovými infekciami; PBMC: mononukleárne bunky periférnej krvi; PET: pozitrónová emisná tomografia; PFC: Prefrontálny kortex; PGE-2: prostaglandín E2; PPAR-
p: nukleárny receptor gama aktivovaný peroxizómovým proliferátorom; QA: kyselina chinolínová; RNS: reaktívne druhy dusíka; ROS: reaktívne formy kyslíka;
sIL: rozpustný interleukín; SLE: systémový lupus erythematosus; SRI: inhibítor spätného vychytávania serotonínu; TNF-a: tumor nekrotizujúci faktor alfa; T-regs: CD4+CD25+FOXP3+ T regulačné bunky; TDO: tryptofán-2,3-dioxygenáza; Th: T-pomocník; VGKC: Napäťovo riadený draslíkový kanál; XAG-: transportér glutamátu aspartátu; Xc-: Astrogliálny glutamát/cystín nezávislý od sodíka
antiportérový systém
Konkurenčných záujmov
Autori vyhlasujú, že nemajú konkurenčné záujmy.
Príspevky autorov��
SN a DMP vykonali rozsiahly prehľad literatúry, interpretovali údaje, pripravili rukopis, obrázky a tabuľky. KA pripravil časť týkajúcu sa oxidačných mechanizmov a prispel k revíziám rukopisov. AN a OD kriticky zrevidovali a zlepšili dizajn a kvalitu rukopisu. Všetci autori prečítali a schválili konečný rukopis.
Poďakovanie
S vďačnosťou oceňujeme Dr. Josep Dalmau, MD, PhD, Tracy Butler, MD a David Zazag, MD, PhD, za poskytnutie ich odborných znalostí v oblasti autoimunitných encefalitíd, zobrazovania neurozápalov a neuropatológie.
Podrobnosti o autorovi
1Department of Neurology, New York University School of Medicine, 550 First Avenue, New York, NY 10016, USA. 2Geisel School of Medicine v Dartmouthe, Dartmouthský inštitút pre zdravotnú politiku a klinickú prax, 30 Lafayette Street, HB 7252, Libanon, NH 03766, USA. 3Department of Pathology, Division of Neuropathology, New York University School of Medicine, 550 First Avenue, New York, NY 10016, USA. 4Department of Psychiatry, New York University School of Medicine, New York, NY, USA. 5 Komplexné centrum pre epilepsiu New York University, 550 First Avenue, New York, NY 10016, USA.
prázdny
Referencie:
1. Kayser MS, Dalmau J: Vznikajúca súvislosť medzi autoimunitnými poruchami
a neuropsychiatrické ochorenie. J Neuropsychiatry Clin Neurosci 2011, 23:90�97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: Kyselina glutámová
syndróm dekarboxylázových autoprotilátok prejavujúci sa ako schizofrénia.
Neurológ 2012, 18:88�91.
3. Graus F, Saiz A, Dalmau J: Protilátky a neuronálne autoimunitné
poruchy CNS. J Neurol 2010, 257:509�517.
4. Lennox BR, Coles AJ, Vincent A: Protilátkami sprostredkovaná encefalitída: a
liečiteľná príčina schizofrénie. Br J Psychiatria 2012, 200:92�94.
5. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P, Coles AJ, Vincent
A, Lennox BR: Autoprotilátky relevantné pre ochorenie v prvej epizóde
schizofrénie. J Neurol 2011, 258:686�688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
Autoimunitná limbická encefalitída u 39 pacientov: imunofenotypy a
výsledky. J Neurol Neurosurg Psychiatry 2007, 78:381�385.
7. Dale RC, Heyman I, Giovannoni G, Church AW: Incidencia anti-mozgu
protilátky u detí s obsedantno-kompulzívnou poruchou. Br J Psychiatria
2005, 187:314�319.
8. Kendler KS: Strakatý charakter príčin psychiatrických chorôb: nahradenie
organicko-funkčná/hardvérovo-softvérová dichotómia s empiricky
založený pluralizmus. Mol Psychiatry 2012, 17:377�388.
9. Keskin G, Sunter G, Midi I, Tuncer N: Neurosyfilis ako príčina kognitívnych porúch
pokles a psychiatrické symptómy v mladšom veku. J Neuropsychiatry Clin
Neurosci 2011, 23:E41�E42.
10. Leboyer M, Soreca I, Scott J, Frye M, Henry C, Tamouza R, Kupfer DJ: Can
možno bipolárnu poruchu považovať za multisystémové zápalové ochorenie?
J Affect Disord 2012, 141:1�10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: Frekvencia depresie po
mŕtvica: systematický prehľad pozorovacích štúdií. Zdvih 2005, 36:1330�1340.
12. Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW: Od
zápal až choroba a depresia: keď imunitný systém
podrobuje si mozog. Nat Rev Neurosci 2008, 9:46�56.
13. Laske C, Zank M, Klein R, Stránský E, Batra A, Buchkremer G, Schott K:
Reaktivita autoprotilátok v sére pacientov s veľkou depresiou,
schizofrénie a zdravých kontrol. Psychiatry Res 2008, 158:83�86.
14. Eisenberger NI, Berkman ET, Inagaki TK, Rameson LT, Mashal NM, Irwin MR:
Anhedónia vyvolaná zápalom: endotoxín znižuje ventrálne striatum
odpovede na odmenu. Biol Psychiatry 2010, 68:748�754.
15. Haroon E, Raison CL, Miller AH: Stretnutie psychoneuroimunológie
neuropsychofarmakológia: translačné dôsledky vplyvu
zápal v správaní. Neuropsychofarmakológia 2012, 37:137�162.
16. Benros ME, Nielsen PR, Nordentoft M, Eaton WW, Dalton SO, Mortensen PB:
Autoimunitné ochorenia a závažné infekcie ako rizikové faktory pre
schizofrénia: 30-ročná štúdia registra populácie. Am J Psychiatria
2011, 168:1303�1310.
17. McNally L, Bhagwagar Z, Hannestad J: Zápal, glutamát a glia
pri depresii: prehľad literatúry. CNS Spectr 2008, 13:501�510.
18. Harrison NA, Brydon L, Walker C, Grey MA, Steptoe A, Critchley HD:
Zápal spôsobuje zmeny nálady prostredníctvom zmien v subgenuálnej oblasti
cingulatívna aktivita a mezolimbická konektivita. Biol Psychiatry 2009,
66:407�414.19. Raison CL, Miller AH: Je depresia zápalová porucha?
Curr Psychiatry Rep 2011, 13:467�475.
20. Raison CL, Miller AH: Evolučný význam depresie v
Obrana hostiteľa patogénu (PATHOS-D). Mol Psychiatria 2013, 18:15�37.
21. Steiner J, Bogerts B, Sarnyai Z, Walter M, Gos T, Bernstein HG, Myint AM:
Preklenutie priepasti medzi imunitnými a glutamátovými hypotézami o
schizofrénia a veľká depresia: Potenciálna úloha gliového NMDA
modulátory receptorov a narušená integrita hematoencefalickej bariéry. Svet J
Biol Psychiatry 2012, 13:482�492.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, Ullrich O, Bernstein HG, Bogerts B:
Distribúcia HLA-DR-pozitívnych mikroglií pri schizofrénii odráža
narušená cerebrálna lateralizácia. Acta Neuropathol 2006, 112:305�316.
23. Papakostas GI, Shelton RC, Kinrys G, Henry ME, Bakow BR, Lipkin SH, Pi B,
Thurmond L, Bilello JA: Hodnotenie viacnásobného testu na báze séra
biologický diagnostický test na veľkú depresívnu poruchu: pilotný a
replikačná štúdia. Mol Psychiatry 2013, 18:332�339.
24. Krishnan R: Unipolárna depresia u dospelých: epidemiológia, patogenéza a
neurobiológia. V UpToDate. Upravil Basow DS. Waltham, MA: UpToDate; 2013.
25. Stovall J: Bipolárna porucha u dospelých: epidemiológia a diagnostika. In
Aktuálny. Upravil Basow DS. Aktualizácia: Waltham; 2013.
26. Fischer BA, Buchanan RW: Schizofrénia: epidemiológia a patogenéza.
V UpToDate. Upravil Basow DS. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: Rodinná štúdia obsedantno-kompulzívnej
porucha. Arch Gen Psychiatry 2000, 57:358�363.
28. Stefansson H, Ophoff RA, Steinberg S, Andreassen OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, B�rglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, B�ttcher Y, Olesen J, Breuer R, M�ller
HJ, Giegling I, et al: Bežné varianty spôsobujúce riziko schizofrénie.
Nature 2009, 460:744�747.
29. M�ller N, Schwarz MJ: Imunitne sprostredkovaná zmena serotonínu a
glutamát: smerom k integrovanému pohľadu na depresiu. Mol Psychiatria
2007, 12:988�1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: Funkčný polymorfizmus
génu cyklooxygenázy-2 (G-765C) u pacientov s depresiou.
Neuropsychobiológia 2010, 62:116�120.
31. Levinson DF: Genetika depresie: prehľad. Biol Psychiatry 2006,
60: 84.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Deng X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: gén S100B
polymorfizmy predpovedajú prefrontálnu priestorovú funkciu u oboch schizofrénií
pacientov a zdravých jedincov. Schizophr Res 2012, 134:89�94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: Rizikové varianty v géne S100B,
spojené so zvýšenými hladinami S100B, sú tiež spojené s
zrakovo-priestorové postihnutie schizofrénie. Behav Brain Res 2011, 217:363�368.
34. Cappi C, Muniz RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, Miguel EC, Guilherme L, Hounie AG: Asociácia
štúdium medzi funkčnými polymorfizmami v géne TNF-alfa a
obsesívno kompulzívna porucha. Arq Neuropsiquiatr 2012, 70:87�90.
35. Miguel-Hidalgo JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Gliálny fibrilárny kyslý proteín
imunoreaktivita v prefrontálnom kortexe odlišuje mladšie od
starších dospelých s ťažkou depresívnou poruchou. Biol Psychiatry 2000, 48:861�873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: Redukcia astrocytov amygdaly u jedincov s
veľká depresívna porucha, ale nie bipolárna porucha. Bipolárna porucha 2010,
12: 541.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
Imunohistochemická lokalizácia fosforylovanej gliálnej fibrilárnej kyseliny
proteín v prefrontálnom kortexe a hipokampe od pacientov s
schizofrénia, bipolárna porucha a depresia. Brain Behav Immun 2001,
15: 388.
38. Doyle C, Deakin JFW: Menej astrocytov vo frontálnom kortexe pri schizofrénii,
depresie a bipolárnej poruchy. Schizophrenia Res 2002, 53:106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey
EF, Yolken RH: Choroby špecifické zmeny v mozgových proteínoch frontálnej kôry
pri schizofrénii, bipolárnej poruche a veľkej depresívnej poruche, The
Stanley Neuropathology Consortium. Mol Psychiatry 2000, 5:142�149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: Regionálne špecifické
zníženie imunoreaktivity gliových fibrilárnych kyslých proteínov v mozgu
potkaní model depresie. Neuroveda 2009, 159:915�925.
41. Banasr M, Duman RS: Strata glia v prefrontálnom kortexe postačuje na
vyvolať depresívne správanie. Biol Psychiatry 2008, 64:863�870.
42. Cotter D, Hudson L, Landau S: Dôkazy pre orbitofrontálnu patológiu v r.
bipolárnej poruchy a veľkej depresie, ale nie pri schizofrénii.
Bipolárna porucha 2005, 7:358�369.
43. Brauch RA, Adnan El-Masri M, Parker J Jr, El-Mallakh RS: Počet gliových buniek
a pomery neurón/gliové bunky v postmortálnych mozgoch bipolárnych jedincov.
J Affect Disord 2006, 91:87�90.
44. Cotter DR, Pariante CM, Everall IP: Hlavné abnormality gliových buniek
psychiatrické poruchy: dôkazy a dôsledky. Brain Res Bull 2001,
55: 585.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: Znížená hustota gliových buniek
a veľkosť neurónov v prednej cingulárnej kôre pri veľkej depresii
porucha. Arch Gen Psychiatry 2001, 58:545�553.
46. Bowley MP, Drevets WC, Ong�r D, Cena JL: Nízke gliové čísla v
amygdala pri veľkej depresívnej poruche. Biol Psychiatry 2002, 52:404�412.
47. Toro CT, Hallak JE, Dunham JS, Deakin JF: Gliálny fibrilárny kyslý proteín a
glutamínsyntetáza v subregiónoch prefrontálneho kortexu pri schizofrénii
a porucha nálady. Neurosci Lett 2006, 404:276�281.
48. Rajkowska G, Miguel-Hidalgo JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: Vrstvovo špecifické zníženie GFAP-reaktívnych astroglií v
dorzolaterálny prefrontálny kortex pri schizofrénii. Schizophr Res 2002, 57:127�138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: Cortical
expresia gliového fibrilárneho kyslého proteínu a glutamínsyntetázy je
znížená pri schizofrénii. Schizophr Res 2008, 103:71�82.
50. Damadzic R, Bigelow LB, Krimer LS, Goldenson DA, Saunders RC, Kleinman
JE, Herman MM: Kvantitatívna imunohistochemická štúdia astrocytov v
entorinálny kortex pri schizofrénii, bipolárnej poruche a major
depresia: absencia významnej astrocytózy. Brain Res Bull 2001, 55:611�618.
51. Beneš FM, McSparren J, Bird ED, SanGiovanni JP, Vincent SL: Deficity v
malé interneuróny v prefrontálnych a cingulárnych kôrach schizofrenických
a schizoafektívnych pacientov. Arch Gen Psychiatry 1991, 48:996�1001.
52. M�ller N, Schwarz MJ: Imunitný systém a schizofrénia. Curr Immunol
Rev 2010, 6:213�220.
53. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: Závažné
depresia je spojená so zvýšenou mikrogliálnou kyselinou chinolínovou v
podoblasti predného cingulárneho gyrusu: dôkaz o imunomodulácii
glutamátergná neurotransmisia? J Neuroinflammation 2011, 8:94.
54. Vostrikov VM, Uranova NA, Orlovskaya DD: Deficit perineuronal
oligodendrocyty v prefrontálnom kortexe pri schizofrénii a nálade
poruchy. Schizophr Res 2007, 94:273�280.
55. Rajkowska G, Miguel-Hidalgo JJ: Gliogenéza a gliová patológia v r.
depresie. CNS Neurol Disord Drug Targets 2007, 6:219�233.
56. Uranova NA, Vostrikov VM, Orlovskaya DD, Rachmanova VI:
Oligodendrogliálna hustota v prefrontálnom kortexe pri schizofrénii a
poruchy nálady: štúdia od Stanley Neuropathology Consortium.
Schizophr Res 2004, 67:269�275.
57. Uranova N: Poškodenie a strata oligodendrocytov sú rozhodujúce v
patogenéza schizofrénie a porúch nálady (nálezy z formy
postmortálne štúdie). Neuropsychopharmacology 2004, 29:S33.
58. Uranova NA, Orlovskaya DD, Vostrikov VM, Rachmanova VI: Kles.
hustota oligodendrogliových satelitov pyramídových neurónov vo vrstve III v
prefrontálny kortex pri schizofrénii a poruchách nálady. Schizophr Res
2002, 53: 107.
59. Vostrikov VM, Uranova NA, Rakhmanova VI, Orlovskaia DD: Znížené
hustota oligodendrogliových buniek v prefrontálnom kortexe pri schizofrénii.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47�51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, Rachmanova VI, Orlovskaya
DD: Ultraštrukturálne poškodenie kapilár v neokortexe v
schizofrénie. World J Biol Psychiatry 2010, 11:567�578.
61. Hof PR, Haroutunian V, Friedrich VL Jr., Byne W, Buitron C, Perl DP, Davis KL:
Strata a zmenená priestorová distribúcia oligodendrocytov v nadradenom
frontálny gyrus pri schizofrénii. Biol Psychiatry 2003, 53:1075�1085.
62. Davis KL, Stewart DG, Friedman JI, Buchsbaum M, Harvey PD, Hof PR,
Buxbaum J, Haroutunian V: Zmeny bielej hmoty pri schizofrénii:
dôkaz dysfunkcie súvisiacej s myelínom. Arch Gen Psychiatry 2003,
60:443�456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: Abnormality of
myelinizácia pri schizofrénii detekovaná in vivo pomocou MRI a postmortem
s analýzou oligodendrocytových proteínov. Mol Psychiatria 2003,
8: 811.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, Kolomeets NS, Orlovskaya
DD: Úloha oligodendrocytovej patológie pri schizofrénii. Int J
Neuropsychopharmacol 2007, 10:537�545.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Haroutunian V: Schizofrénia spojená redukcia neurónových a
počet oligodendrocytov v prednom hlavnom talamickom jadre.
Schizophr Res 2006, 85:245�253.
66. Hamidi M, Drevets WC, Cena JL: Gliálna redukcia amygdaly v dur
depresívna porucha je spôsobená oligodendrocytmi. Biol Psychiatry 2004,
55: 563.
67. Bayer TA, Buslei R, Havas L, Falkai P: Dôkazy aktivácie mikroglií v r.
pacientov s psychiatrickými ochoreniami. Neurosci Lett 1999, 271:126�128.
68. Steiner J, Bielau H, Brisch R, Danos P, Ullrich O, Mawrin C, Bernstein HG,
Bogerts B: Imunologické aspekty v neurobiológii samovrážd:
zvýšená hustota mikroglií pri schizofrénii a depresii je
spojené so samovraždou. J Psychiatr Res 2008, 42:151�157.
69. Rao JS, Harry GJ, Rapoport SI, Kim HW: Zvýšená excitotoxicita a
neurozápalové markery v postmortálnom frontálnom kortexe z bipolárnej
pacientov s poruchami. Mol Psychiatry 2010, 15:384�392.
70. Bernstein HG, Steiner J, Bogerts B: Gliové bunky pri schizofrénii:
patofyziologický význam a možné dôsledky pre terapiu.
Expert Rev Neurother 2009, 9:1059�1071.
71. Chen SK, Tvrdík P, Peden E, Cho S, Wu S, Spangrude G, Capecchi MR:
Hematopoetický pôvod patologického groomingu u Hoxb8 mutantných myší.
Cell 2010, 141:775�785.
72. Antony JM: Ošetrovanie a pestovanie s mikrogliami. Sci Signal 2010, 3:jc8.
73. Wonodi I, Stine OC, Sathyasaikumar KV, Roberts RC, Mitchell BD, Hong LE,
Kajii Y, Thaker GK, Schwarcz R: Znížená regulácia kynurenínu 3-
expresia génu monooxygenázy a aktivita enzýmov pri schizofrénii
a genetická asociácia s endofenotypmi schizofrénie. Arch Gen
Psychiatria 2011, 68:665�674.
74. Raison CL, Lowry CA, Rook GA: Zápal, sanitácia a
zdesenie: strata kontaktu s koevolvovaným, tolerogénnym
mikroorganizmov a patofyziológia a liečba hl
depresie. Arch Gen Psychiatry 2010, 67:1211�1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: Aktivácia sietí monocytov a T buniek u pacientov
s bipolárnou poruchou. Brain Behav Immun 2011, 25:1206�1213.
76. Steiner J, Jacobs R, Panteli B, Brauner M, Schiltz K, Bahn S, Herberth M,
Westphal S, Gos T, Walter M, Bernstein HG, Myint AM, Bogerts B: Akútne
schizofréniu sprevádza znížený počet T buniek a zvýšený počet B buniek
imunita. Eur Arch Psychiatry Clin Neurosci 2010, 260:509�518.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: The
genetická imunitná hypotéza založená na glutamáte pri obsedantno-kompulzívnej
porucha, Integračný prístup od génov k symptómom.
Neuroveda 2010, 165:408�417.
78. Y�ksel C, Ong�r D: Štúdie magnetickej rezonančnej spektroskopie
abnormality súvisiace s glutamátom pri poruchách nálady. Biol Psychiatry 2010,
68: 785.
79. Rao JS, Kellom M, Reese EA, Rapoport SI, Kim HW: Dysregulated glutamate
a dopamínové transportéry v posmrtnom frontálnom kortexe z bipolárnej
a schizofrenických pacientov. J Affect Disord 2012, 136:63�71.
80. Bauer D, Gupta D, Harotunian V, Meador-Woodruff JH, McCullumsmith RE:
Abnormálna expresia glutamátového transportéra a transportéra
interagujúce molekuly v prefrontálnom kortexe u starších pacientov s
schizofrénie. Schizophr Res 2008, 104:108�120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: Zvýšená expresia
astrocytického glutamátového transportéra GLT-1 v prefrontálnom kortexe
schizofrenici. 2005, 49:451�455.
82. Smith RE, Haroutunian V, Davis KL, Meador-Woodruff JH: Expression of
transkripty transportéra excitačných aminokyselín v talame subjektov
so schizofréniou. Am J Psychiatry 2001, 158:1393�1399.
83. McCullumsmith RE, Meador-Woodruff JH: Striatálna excitačná aminokyselina
expresia transportného transkriptu pri schizofrénii, bipolárnej poruche,
a veľkú depresívnu poruchu. Neuropsychofarmakológia 2002,
26: 368.
84. Pittenger C, Bloch MH, Williams K: Glutamátové abnormality v obsedantoch
kompulzívna porucha: neurobiológia, patofyziológia a liečba.
Pharmacol Ther 2011, 132:314�332.
85. Hashimoto K: Vznikajúca úloha glutamátu v patofyziológii
veľká depresívna porucha. Brain Res Rev 2009, 61:105�123.
86. Hashimoto K, Sawa A, Iyo M: Zvýšené hladiny glutamátu v mozgu z
pacientov s poruchami nálady. Biol Psychiatry 2007, 62:1310�1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, Vorobyeva EA, Savushkina OK,
Tereshkina EB: Glutamínsyntetáza a glutamátdehydrogenáza v
prefrontálny kortex pacientov so schizofréniou. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675�680.
88. Bhattacharyya S, Khanna S, Chakrabarty K, Mahadevan A, Christopher R,
Shankar SK: Anti-mozgové autoprotilátky a zmenené excitačné
neurotransmitery pri obsedantno-kompulzívnej poruche.
Neuropsychopharmacology 2009, 34:2489�2496.
89. Sanacora G, Gueorguieva R, Epperson CN, Wu YT, Appel M, Rothman DL,
Krystal JH, Mason GF: Subtypovo špecifické zmeny gamaaminomaslovej
kyseliny a glutamátu u pacientov s veľkou depresiou.
Arch Gen Psychiatry 2004, 61:705�713.
90. Marsman A, van den Heuvel MP, Klomp DW, Kahn RS, Luijten PR, Hulshoff
Pol HE: Glutamát pri schizofrénii: zameraný prehľad a metaanalýza
1H-MRS štúdií. Schizophr Bull 2013, 39:120�129.
91. Liu Y, Ho RC, Mak A: Interleukín (IL)-6, tumor nekrotizujúci faktor alfa
(TNF-alfa) a rozpustné receptory interleukínu-2 (sIL-2R) sú zvýšené v
pacienti s veľkou depresívnou poruchou: metaanalýza a metaregresia.
J Affect Disord 2012, 139:230�239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: Cytokíny v bipolárnej oblasti
porucha: nedávne zistenia, škodlivé účinky, ale prísľub do budúcnosti
terapeutiká. CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx?articleid=3596.
93. Denys D, Fluitman S, Kavelaars A, Heijnen C, Westenberg H: Zníženie
Aktivita TNF-alfa a NK pri obsedantno-kompulzívnej poruche.
Psychoneuroendokrinológia 2004, 29:945�952.
94. Brambilla F, Perna G, Bellodi L, Arancio C, Bertani A, Perini G, Carraro C, Gava
F: Plazmatické koncentrácie interleukínu-1 beta a tumor nekrotizujúceho faktora v
obsedantno-kompulzívne poruchy. Biol Psychiatry 1997, 42:976�981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Lipopolysacharidmi indukovaná produkcia cytokínov pri obsedantno-kompulzívnej
poruchy a generalizovanej sociálnej úzkostnej poruchy. Psychiatria
Res 2010, 178:313�316.
96. Janelidze S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Cytokín
hladiny v krvi môžu rozlíšiť pokusov o samovraždu od depresívnych
pacientov. Brain Behav Immun 2011, 25:335�339.
97. Postal M, Costallat LT, Appenzeller S: Neuropsychiatrické prejavy v
systémový lupus erythematosus: epidemiológia, patofyziológia a
zvládanie. CNS Drugs 2011, 25:721�736.
98. Kozora E, Hanly JG, Lapteva L, Filly CM: Kognitívna dysfunkcia v
systémový lupus erythematosus: minulosť, prítomnosť a budúcnosť.
Arthritis Rheum 2008, 58:3286�3298.
99. Lancaster E, Martinez-Hernandez E, Dalmau J: Encefalitída a protilátky proti
synaptické a neurónové bunkové povrchové proteíny. Neurológia 2011, 77:179�189.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: Klinické skúsenosti a laboratórne vyšetrenia u pacientov s antiNMDAR
encefalitída. Lancet Neurol 2011, 10:63�74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: Skúmanie LGI1 ako antigénu pri limbickej encefalitíde
predtým pripisované draslíkovým kanálom: séria prípadov. Lancet Neurol
2010, 9:776�785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Hernandez E,
Wilson C, Jacobs D, Lai M, Walker RW, Graus F, Bataller L, Illa I, Markx S, Strauss
KA, Peles E, Scherer SS, Dalmau J: Investigations of caspr2, autoantigén of
encefalitída a neuromyotónia. Ann Neurol 2011, 69:303�311.
103. Lancaster E, Lai M, Peng X, Hughes E, Constantinescu R, Raizer J, Friedman
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: Protilátky proti GABA(B) receptoru v
limbická encefalitída so záchvatmi: séria prípadov a charakterizácia
antigén. Lancet Neurol 2010, 9:67�76.
104. Lancaster E, Martinez-Hernandez E, Titulaer MJ, Boulos M, Weaver S, Antoine
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, Dodávateľ A,
Balice-Gordon R, Dalmau J: Protilátky proti metabotropnému glutamátu
receptor 5 pri syndróme Ofélie. Neurológia 2011, 77:1698�1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: Responsive treatment
limbická encefalitída identifikovaná neuropilovými protilátkami: MRI a
PET koreluje. Brain 2005, 128:1764�1777.
106. Tofaris GK, Irani SR, Cheeran BJ, Baker IW, Cader ZM, Vincent A:
Chorea reagujúca na imunoterapiu ako prezentačný znak LGI1-
protilátková encefalitída. Neurológia 2012, 79:195�196.
107. Najjar S, Pearlman D, Najjar A, Ghiasian V, Zagzag D, Devinsky O:
Extralimbická autoimunitná encefalitída spojená s kyselinou glutámovou
dekarboxylázové protilátky: nedostatočne diagnostikovaná entita? Správanie pri epilepsii
2011, 21:306�313.
108. Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T, Honig
LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N,
Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F,
Dalmau J: Liečba a prognostické faktory pre dlhodobý výsledok v
pacienti s anti-NMDA receptorovou encefalitídou: pozorovacia kohorta
štúdium. Lancet Neurol 2013, 12:157�165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Rosenfeld MR, Balice-Gordon R, Lynch DR: Anti-NMDA-receptor
encefalitída: séria prípadov a analýza účinkov protilátok.
Lancet Neurol 2008, 7:1091�1098.
110. Graus F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: Rozširujúci sa klinický profil anti-AMPA receptora
encefalitída. Neurológia 2010, 74:857�859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
D, Vitaliani R, Geschwind MD, Bataller L, Kalb RG, Davis R, Graus F, Lynch DR,
Balice-Gordon R, Dalmau J: Protilátky receptora AMPA v limbe
encefalitída mení umiestnenie synaptických receptorov. Ann Neurol 2009, 65:424�434.
112. Najjar S, Pearlman D, Devinsky O, Najjar A, Nadkarni S, Butler T, Zagzag D:
Neuropsychiatrická autoimunitná encefalitída s negatívnym komplexom VGKC,
NMDAR a autoprotilátky GAD: kazuistika a prehľad literatúry,
nadchádzajúce. Cogn Behav Neurol. v tlači.
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: Spontánne riešenie
séronegatívna autoimunitná limbická encefalitída. Cogn Behav Neurol 2011,
24: 99.
114. Gabilondo I, Saiz A, Galan L, Gonzalez V, Jadraque R, Sabater L, Sans A,
Sempere A, Vela A, Villalobos F, Vi�als M, Villoslada P, Graus F: Analýza
relapsy anti-NMDAR encefalitídy. Neurológia 2011, 77:996�999.
115. Barry H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, Murphy KC: Anti-NMDA receptorová encefalitída: dôležitá
diferenciálna diagnostika pri psychóze. Br J Psychiatry 2011, 199:508�509.
116. Dickerson F, Stallings C, Vaughan C, Origoni A, Khushalani S, Yolken R:
Protilátky proti glutamátovému receptoru pri mánii. Bipolárna porucha 2012,
14: 547.
117. O'Loughlin K, Ruge P, McCauley M: Encefalitída a schizofrénia: a
vec slov. Br J Psychiatria 2012, 201:74.
118. Parratt KL, Allan M, Lewis SJ, Dalmau J, Halmagyi GM, Spies JM: Akútna
psychiatrické ochorenie u mladej ženy: nezvyčajná forma encefalitídy.
Med J Aust 2009, 191:284�286.
119. Suzuki Y, Kurita T, Sakurai K, Takeda Y, Koyama T: Prípadová správa anti-NMDA
receptorová encefalitída s podozrením na schizofréniu. Seishin Shinkeigaku
Zasshi 2009, 111:1479�1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
Hishikawa Y, Shimizu T, Nishino S: Detegovaná anti-NMDA-receptorová protilátka
pri encefalitíde, schizofrénii a narkolepsii s psychotickými črtami.
BMC Psychiatria 2012, 12:37.
121. Van Putten WK, Hachimi-Idrissi S, Jansen A, Van Gorp V, Huyghens L:
Menej častá príčina psychotického správania u 9-ročného dievčaťa: prípad
správa. Case Report Med 2012, 2012:358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
Leon J, Berman KF, Dalmau J: Sérové IgG protilátky proti NR1
podjednotka NMDA receptora nebola detegovaná pri schizofrénii. Am J
Psychiatria 2012, 169:1120�1121.
123. Kirvan CA, Swedo SE, Kurahara D, Cunningham MW: mimikry streptokokov
a protilátkami sprostredkovaná bunková signalizácia v patogenéze
Sydenhamova chorea. Autoimunita 2006, 39:21-29.
124. Swedo SE: Streptokoková infekcia, Tourettov syndróm a OCD: existuje
spojenie? Pandy: Kôň alebo zebra? Neurológia 2010, 74:1397�1398.
125. Morer A, Lazaro L, Sabater L, Massana J, Castro J, Graus F: Antineuronal
protilátok v skupine detí s obsedantno-kompulzívnou poruchou
a Tourettov syndróm. J Psychiatr Res 2008, 42:64�68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
Protilátky proti mozgu v PANDAS verzus nekomplikovaný streptokok
infekcia. Pediatr Neurol 2004, 30:107�110.
127. Maina G, Albert U, Bogetto F, Borghese C, Berro AC, Mutani R, Rossi F,
Vigliani MC: Protilátky proti mozgu u dospelých pacientov s obsedantno-kompulzívnou poruchou
porucha. J Affect Disord 2009, 116:192�200.
128. Brimberg L, Benhar I, Mascaro-Blanco A, Alvarez K, Lotan D, Winter C, Klein J,
Moses AE, Somnier FE, Leckman JF, Swedo SE, Cunningham MW, Joel D:
Behaviorálne, farmakologické a imunologické abnormality po
streptokoková expozícia: nový potkaní model Sydenhamovej chorey a
súvisiace neuropsychiatrické poruchy. Neuropsychofarmakológia 2012,
37: 2076.
129. Dale RC, Candler PM, Church AJ, Wait R, Pocock JM, Giovannoni G:
Neurónové povrchové glykolytické enzýmy sú autoantigénne ciele v
poststreptokokové autoimunitné ochorenie CNS. J Neuroimmunol 2006,
172: 187.
130. Nicholson TR, Ferdinando S, Krishnaiah RB, Anhoury S, Lennox BR, MataixCols
D, Cleare A, Veale DM, Drummond LM, Fineberg NA, Church AJ,
Giovannoni G, Heyman I: Prevalencia protilátok proti bazálnym gangliám v
obsedantno-kompulzívna porucha dospelých: prierezová štúdia. Br J Psychiatria
2012, 200:381�386.
131. Wu K, Hanna GL, Rosenberg DR, Arnold PD: Úloha glutamátu
signalizácia v patogenéze a liečbe obsedantno-kompulzívnych
porucha. Pharmacol Biochem Behav 2012, 100:726�735.
132. Perlmutter SJ, Leitman SF, Garvey MA, Hamburger S, Feldman E, Leonard
HL, Swedo SE: Terapeutická výmena plazmy a intravenózna
imunoglobulín na obsedantno-kompulzívnu poruchu a tikové poruchy v
detstva. Lancet 1999, 354:1153�1158.
133. Pereira A Jr, Furlan FA: Astrocyty a ľudské poznanie: modelovanie
integrácia informácií a modulácia neuronálnej aktivity.
Prog Neurobiol 2010, 92:405�420.
134. Barres BA: Tajomstvo a mágia glií: pohľad na ich úlohy v
zdravie a choroba. Neuron 2008, 60:430-440.
135. Verkhratsky A, Parpura V, Rodriguez JJ: Kde prebývajú myšlienky:
fyziológia neurónovo-gliálnej „difúznej nervovej siete“. Brain Res Rev 2011,
66: 133.
136. Sofroniew MV: Molekulárna disekcia reaktívnej astrogliózy a gliovej jazvy
tvorenie. Trends Neurosci 2009, 32:638�647.
137. Hamilton NB, Attwell D: Naozaj exocytujú astrocyty neurotransmitery?
Nat Rev Neurosci 2010, 11:227�238.
138. Rajkowska G: Posmrtné štúdie porúch nálady poukazujú na zmenené
počet neurónov a gliových buniek. Biol Psychiatry 2000, 48:766�777.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
Znížený prefrontálny myo-inozitol pri veľkej depresívnej poruche.
Biol Psychiatry 2005, 57:1526�1534.
140. Miguel-Hidalgo JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: Vaskulárna a extravaskulárna imunoreaktivita
pre intercelulárnu adhéznu molekulu 1 v orbitofrontálnom kortexe
subjekty s veľkou depresiou: zmeny závislé od veku. J Affect Disord
2011, 132:422�431.
141. Miguel-Hidalgo JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: Glia patológia v prefrontálnom kortexe v alkohole
závislosť s depresívnymi príznakmi a bez nich. Biol Psychiatry 2002,
52: 1121.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Bunkové zmeny po smrti
hippocampus pri ťažkej depresii. Biol Psychiatry 2004, 56:640�650.
143. Ong�r D, Drevets WC, Cena JL: Gliálna redukcia v subgenuálnej prefrontálnej oblasti
kôra pri poruchách nálady. Proc Natl Acad Sci USA 1998, 95:13290�13295.
144. Gittins RA, Harrison PJ: Morfometrická štúdia glií a neurónov v
predná cingulárna kôra pri poruche nálady. J Affect Disord 2011,
133: 328.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: Znížená hustota glií
a neurónový objem pri veľkej depresívnej poruche a schizofrénii v
predná cingulárna kôra [abstrakt]. Schizophrenia Res 2000, 41:106.
146. Si X, Miguel-Hidalgo JJ, Rajkowska G: Expresia GFAP je znížená v
dorzolaterálny prefrontálny kortex pri depresii. In Society for Neuroscience; 2003.
Plán stretnutia neurovedy: New Orleans; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: Astrocyty bielej hmoty
sú znížené pri depresii. In Spoločnosť pre neurovedy. Neurovedné stretnutie
Plánovač: Washington, DC; 2011.148. Edgar N, Sibille E: Predpokladaná funkčná úloha pre oligodendrocyty v
regulácia nálady. Transl Psychiatry 2012, 2:e109.
149. Rajkowska G, Halaris A, Selemon LD: Reductions in neuronal and glial
hustota charakterizujú dorzolaterálny prefrontálny kortex v bipolárnom
porucha. Biol Psychiatry 2001, 49:741�752.
150. Cotter D, Mackay D, Chana G, Beasley C, Landau S, Everall IP: Znížená
veľkosť neurónov a hustota gliových buniek v oblasti 9 dorzolaterálnej
prefrontálny kortex u jedincov s veľkou depresívnou poruchou. Cereb Cortex
2002, 12:386�394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: Strata gliových buniek v
anterior cingulate cortex, podoblasť prefrontálneho kortexu, v
subjekty so schizofréniou. Am J Psychiatry 2004, 161:882�888.
152. Konopaske GT, Dorph-Petersen KA, Sweet RA, Pierri JN, Zhang W, Sampson
AR, Lewis DA: Vplyv chronickej antipsychotickej expozície na astrocyty a
počet oligodendrocytov u makakov. Biol Psychiatry 2008,
63: 759.
153. Selemon LD, Lidow MS, Goldman-Rakic PS: Zvýšený objem a gliál
hustota v prefrontálnom kortexe primátov spojená s chronickým
expozícia antipsychotickým liekom. Biol Psychiatry 1999, 46:161�172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B-imunopozitívna glia je
zvýšená paranoidná v porovnaní s reziduálnou schizofréniou: a
morfometrická štúdia. J Psychiatr Res 2008, 42:868�876.
155. Carter CJ: eIF2B a prežitie oligodendrocytov: kde príroda a výchova
stretnúť pri bipolárnej poruche a schizofrénii? Schizophr Bull 2007,
33: 1343.
156. Hayashi Y, Nihonmatsu-Kikuchi N, Hisanaga S, Yu XJ, Tatebayashi Y:
Neuropatologické podobnosti a rozdiely medzi schizofréniou
a bipolárna porucha: prietoková cytometrická postmortálna štúdia mozgu.
PLoS One 2012, 7:e33019.
157. Uranova NA, Vikhreva OV, Rachmanova VI, Orlovskaya DD: Ultrastructural
zmeny myelinizovaných vlákien a oligodendrocytov v prefrontálnej časti
kôra pri schizofrénii: postmortálna morfometrická štúdia.
Liečba Schizophr Res 2011, 2011: 325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
G, Mechawar N: Astrocytická hypertrofia v prednej cingulárnej bielej
záležitosť depresívnych samovrážd. Neuropsychofarmakológia 2011,
36: 2650.
159. Pereira A Jr, Furlan FA: O úlohe synchrónie pre neurón-astrocyt
interakcie a percepčné vedomé spracovanie. J Biol Phys 2009,
35: 465.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A: Fyziológia
mikroglie. Physiol Rev 2011, 91:461�553.
161. Tremblay ME, Stevens B, Sierra A, Wake H, Bessis A, Nimmerjahn A: Úloha
mikroglií v zdravom mozgu. J Neurosci 2011, 31:16064�16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, Loron G, Le
Charpentier T, Josserand J, Ali C, Vivien D, Collingridge GL, Lombet A, Issa L,
Rene F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: Aktivácia
mikrogliálne N-metyl-D-aspartátové receptory spúšťa zápal a
smrť neurónových buniek vo vyvíjajúcom sa a zrelom mozgu. Ann Neurol
2012, 72:536�549.
163. Schwartz M, Shaked I, Fisher J, Mizrahi T, Schori H: Ochranný
autoimunita proti nepriateľovi vo vnútri: boj proti toxicite glutamátu.
Trends Neurosci 2003, 26:297�302.
164. Pacheco R, Gallart T, Lluis C, Franco R: Úloha glutamátu na T-bunke
sprostredkovaná imunita. J Neuroimmunol 2007, 185:9:19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: Refraktérna epilepsia spojená
s mikrogliálnou aktiváciou. Neurológ 2011, 17:249�254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: Mikrogliálny fenotyp: je
záväzok reverzibilný? Trends Neurosci 2006, 29:68�74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: Migrácia makrofágov
inhibičný faktor aktivuje cyklooxygenázu 2-prostaglandín E2 v kultiv
miechové mikroglie. Neurosci Res 2011, 71:210�218.
168. Zhang XY, Xiu MH, Song C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: Zvýšené sérum S100B u nikdy neliečených a neliečených
schizofrenických pacientov. J Psychiatr Res 2010, 44:1236�1240.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: Cytokínové mechanizmy centrálnej
senzibilizácia: odlišná a prekrývajúca sa úloha interleukínu-1beta,
interleukín-6 a tumor nekrotizujúci faktor-alfa pri regulácii synaptických a
neuronálna aktivita v povrchovej mieche. J Neurosci 2008,
28: 5189.
170. M�ller N, Schwarz MJ: Imunologický základ glutamátergika
porucha pri schizofrénii: smerom k integrovanému pohľadu. J Neural
Transm Suppl 2007, 72:269�280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: Zvýšené plazmatické hladiny
tumor nekrotizujúceho faktora alfa u pacientov s depresiou: normalizácia
počas elektrokonvulzívnej terapie. J ECT 2003, 19:183�188.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
Plazmatické hladiny interleukínu-6, interleukínu-10 a receptora interleukínu-1
antagonista pri depresii: porovnanie medzi akútnym stavom a po ňom
remisie. Pol J Pharmacol 2000, 52:237-241.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Metaanalýza
cytokínové zmeny pri schizofrénii: klinický stav a antipsychotiká
účinky. Biol Psychiatry 2011, 70:663�671.
174. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E: Zápalové
cytokínové zmeny pri schizofrénii: systematický kvantitatívny prehľad.
Biol Psychiatry 2008, 63:801�808.
175. Reale M, Patruno A, De Lutiis MA, Pesce M, Felaco M, Di Giannantonio M, Di
Nicola M, Grilli A: Dysregulácia produkcie chemo-cytokínov v
schizofrenických pacientov oproti zdravým kontrolám. BMC Neurosci 2011, 12:13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: Znechutenie ovplyvňuje TNFalfa,
Hladiny IL-6 a noradrenalínu u pacientov s obsedantno-kompulzívnou poruchou
porucha. Psychoneuroendokrinológia 2010, 35:906�911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektas S, Erdogan A: Plazma
hladiny tumor nekrotizujúceho faktora-alfa a interleukínu-6 pri obsedantoch
kompulzívna porucha. Mediators Inflamm 2007, 2007:65704.
178. Monteleone P, Catapano F, Fabrazzo M, Tortorella A, Maj M: Zníženie
krvné hladiny tumor nekrotizujúceho faktora alfa u pacientov s obsedantno-kompulzívnym stavom
porucha. Neuropsychobiology 1998, 37:182�185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, Rossi A, Sbrana S, Rocchi V,
Ambrogi F, Cassano GB: Imunologické zmeny v obsedantno-kompulzívnych dospelých
porucha. Biol Psychiatry 1999, 46:810�814.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: Nekróza nádorov
gén faktora-alfa nie je spojený s obsedantno-kompulzívnou poruchou.
Psychiatr Genet 2006, 16:43.
181. Rodr�guez AD, Gonz�lez PA, Garc�a MJ, de la Rosa A, Vargas M, Marrero F:
Cirkadiánne variácie v koncentráciách prozápalových cytokínov pri akút
infarkt myokardu. Rev Esp Cardiol 2003, 56:555�560.
182. Oliver JC, Bland LA, Oettinger CW, Arduino MJ, McAllister SK, Aguero SM,
Favero MS: Kinetika cytokínov v in vitro modeli plnej krvi
endotoxínová výzva. Lymphokine Cytokine Res 1993, 12:115-120.
183. Le T, Leung L, Carroll WL, Schibler KR: Regulácia génu interleukínu-10
výraz: možné mechanizmy zodpovedné za jeho upreguláciu a za
maturačné rozdiely v jeho expresii krvnými mononukleárnymi bunkami.
Blood 1997, 89:4112-4119.
184. Lee MC, Ting KK, Adams S, Brew BJ, Chung R, Guillemin GJ:
Charakterizácia expresie NMDA receptorov u človeka
astrocyty. PLoS One 2010, 5:e14123.
185. Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
Kynurenínová dráha pri veľkej depresii: dôkaz narušenia
neuroprotekcia. J Affect Disord 2007, 98:143�151.
186. Sanacora G, Treccani G, Popoli M: Smerom k glutamátovej hypotéze
depresia: vznikajúca hranica neuropsychofarmakológie pre
poruchy nálady. Neurofarmakológia 2012, 62:63�77.
187. Saleh A, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: V
vivo MRI zápalu mozgu pri ľudskej ischemickej cievnej mozgovej príhode. Brain 2004,
127: 1670.
188. Tilleux S, Hermans E: Neurozápal a regulácia gliového glutamátu
vychytávanie pri neurologických poruchách. J Neurosci Res 2007, 85:2059�2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: In vitro
dôkaz pre hypotézu odtoku glutamátu z mozgu: mozgový endotel
bunky kokultivované s astrocytmi vykazujú polarizovanú komunikáciu medzi mozgom a krvou
transport glutamátu. 2012, 60:882�893.
190. Leonard BE: Koncept depresie ako dysfunkcie imunity
systému. Curr Immunol Rev 2010, 6:205�212.
191. Labrie V, Wong AH, Roder JC: Príspevky D-serínovej dráhy k
schizofrénie. Neuropharmacology 2012, 62:1484�1503.
192. Gras G, Samah B, Hubert A, Leone C, Porcheray F, Rimaniol AC: EAAT
expresia makrofágmi a mikrogliami: ešte viac otázok ako
odpovede. Aminokyseliny 2012, 42:221�229.
193. Livingstone PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
Presluchy glutamátu a dopamínu v prefrontálnom kortexe potkanov sú modulované alfa7 nikotínovými receptormi a potencované PNU-120596. J Mol
Neurosci 2010, 40:172�176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: Ako funguje glialneuronal
interakcie zapadajú do súčasných hypotéz neurotransmiterov
schizofrénia? Neurochem Int 2007, 50:291�301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: The
antagonista alfa7 nikotínového receptora odvodený od astrocytov kyselina kynurénová
kontroluje extracelulárne hladiny glutamátu v prefrontálnom kortexe. J Mol
Neurosci 2010, 40:204�210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: S100B proteín v
neurodegeneratívne poruchy. Clin Chem Lab Med 2011, 49:409�424.
197. Steiner J, Marquardt N, Pauls I, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
Schmidt RE, Jacobs R: Ľudské CD8(+) T bunky a NK bunky exprimujú a
po stimulácii vylučujú S100B. Brain Behav Immun 2011, 25:1233�1241.
198. Shanmugam N, Kim YS, Lanting L, Natarajan R: Regulácia
expresia cyklooxygenázy-2 v monocytoch ligáciou receptora
pre koncové produkty pokročilej glykácie. J Biol Chem 2003, 278:34834-34844.
199. Rothermundt M, Ohrmann P, Abel S, Siegmund A, Pedersen A, Ponath G,
Suslow T, Peters M, Kaestner F, Heindel W, Arolt V, Pfleiderer B: Gliová bunka
aktivácia v podskupine pacientov so schizofréniou indikovaná
zvýšené sérové koncentrácie S100B a zvýšený myo-inozitol.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361�364.
200. Falcone T, Fazio V, Lee C, Simon B, Franco K, Marchi N, Janigro D: Sérum
S100B: potenciálny biomarker suicidality u adolescentov? PLoS One
2010, 5:e11089.
201. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Sérum
markery podporujú gliovú patológiu špecifickú pre ochorenie pri veľkej depresii.
J Affect Disord 2008, 111:271�280.
202. Rothermundt M, Ahn JN, Jorgens S: S100B pri schizofrénii: aktualizácia.
Gen Physiol Biophys 2009, 28 Spec No Focus:F76�F81.
203. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Neuronspecific
enoláza je nezmenená, zatiaľ čo S100B je zvýšená v sére
pacienti so schizofréniou – pôvodný výskum a metaanalýza.
Psychiatry Res 2009, 167:66�72.
204. Rothermundt M, Missler U, Arolt V, Peters M, Leadbeater J, Wiesmann M,
Rudolf S, Wandinger KP, Kirchner H: Zvýšené hladiny S100B v krvi v
neliečených a liečených schizofrenických pacientov koreluje s
negatívna symptomatológia. Mol Psychiatry 2001, 6:445�449.
205. Suchanková P, Klang J, Cavanna C, Holm G, Nilsson S, Jonsson EG, Ekman A:
Je polymorfizmus Gly82Ser v géne RAGE relevantný pre?
schizofrénia a osobnostná črta psychotizmus? J Psychiatry Neurosci
2012, 37:122�128.
206. Scapagnini G, Davinelli S, Drago F, De Lorenzo A, Oriani G: Antioxidanty ako
antidepresíva: skutočnosť alebo fikcia? CNS Drugs 2012, 26:477�490.
207. Ng F, Berk M, Dean O, Bush AI: Oxidačný stres pri psychiatrických poruchách:
dôkazovú základňu a terapeutické dôsledky. Int J Neuropsychopharmacol
2008, 11:851�876.
208. Salim S, Chugh G, Asghar M: Zápal pri úzkosti. Adv Protein Chem
Struct Biol 2012, 88:1�25.
209. Anderson G, Berk M, Dodd S, Bechter K, Altamura AC, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, M�ller N,
Kanchanatawan B, Maes M: Imunozápalové, oxidačné a nitrozatívne
stres a neuroprogresívne dráhy v etiológii, priebehu a liečbe
schizofrénie. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Coughlin JM, Ishizuka K, Kano SI, Edwards JA, Seifuddin FT, Shimano MA,
Daley EL a kol.: Výrazné zníženie rozpustnej superoxiddismutázy-1
(SOD1) v mozgovomiechovom moku pacientov s nedávnym nástupom ochorenia
schizofrénie. Mol Psychiatria 2012, 18:10�11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, Petracca R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: Profilovanie proteínového poľa v sére pacientov s tikom odhaľuje a
široký rozsah a zvýšená imunitná odpoveď proti skupine A
Streptokokové antigény. PLoS One 2009, 4:e6332.
212. Valerio A, Cardile A, Cozzi V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, Clementi E, Moncada S, Carruba MO, Nisoli E: TNF-alfa
downreguluje expresiu eNOS a mitochondriálnu biogenézu v tuku
a svalovina obéznych hlodavcov. J Clin Invest 2006, 116:2791�2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: Mitochondrie, oxidačné
stres a bunková smrť. Apoptóza 2007, 12:913�922.
214. Shalev H, Serlin Y, Friedman A: Prelomenie hematoencefalickej bariéry ako brána
k psychickej poruche. Kardiovaskulárna psychiatria Neurol 2009, 2009:278531.
215. Abbott NJ, Ronnback L, Hansson E: Interakcie astrocytov a endotelu
hematoencefalická bariéra. Nat Rev Neurosci 2006, 7:41�53.
216. Bechter K, Reiber H, Herzog S, Fuchs D, Tumani H, Maxeiner HG:
Analýza cerebrospinálnej tekutiny v afektívnom a schizofrenickom spektre
poruchy: identifikácia podskupín s imunitnými odpoveďami a
dysfunkcia hematoencefalickej bariéry. J Psychiatr Res 2010, 44:321�330.
217. Harris LW, Wayland M, Lan M, Ryan M, Giger T, Lockstone H, Wuethrich I,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: The cerebral
mikrovaskulatúra pri schizofrénii: štúdia mikrodisekcie laserového záchytu.
PLoS One 2008, 3:e3964.
218. Lin JJ, Mula M, Hermann BP: Odkrývanie neurobehaviorálnych
komorbidity epilepsie počas života. Lancet 2012, 380:1180�1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: Vplyv fluoxetínu na
aortálna vazorelaxácia závislá od oxidu dusnatého v nepredvídateľnom
chronický mierny stresový model depresie u myší. Psychosom Med 2012,
74: 63.
220. Zhang XY, Zhou DF, Cao LY, Zhang PY, Wu GY, Shen YC: Účinok
liečba risperidónom na superoxiddismutázu pri schizofrénii. J Clin
Psychopharmacol 2003, 23:128�131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: Asociácia medzi
klinická depresia a endoteliálna funkcia meraná predlaktím
hyperemická reaktivita. Psychosom Med 2010, 72:20�26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, Newman SC, Baker G, Lara N,
Le Melledo JM: Zmena znížených plazmatických NO metabolitov a
aktivita trombocytovej NO syntázy paroxetínom u depresívnych pacientov.
Neuropsychopharmacology 2006, 31:1286�1293.
223. Chrapko WE, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
Znížená aktivita syntázy oxidu dusnatého krvných doštičiek a plazmatického oxidu dusnatého
metabolitov pri veľkej depresívnej poruche. Biol Psychiatry 2004, 56:129�134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: Aktualizácia mechanizmu
a katalytická regulácia v NO syntázach. J Biol Chem 2004,
279: 36167.
225. Chen W, Druhan LJ, Chen CA, Hemann C, Chen YR, Berka V, Tsai AL, Zweier
JL: Peroxynitrit indukuje deštrukciu tetrahydrobiopterínu a
hém v endoteliálnej syntáze oxidu dusnatého: prechod z reverzibilného do
ireverzibilná inhibícia enzýmov. Biochemistry 2010, 49:3129�3137.
226. Chen CA, Wang TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, Chen
YR, Druhan LJ, Zweier JL: S-glutationylácia oddeľuje eNOS a
reguluje jeho bunkovú a vaskulárnu funkciu. Príroda 2010, 468:1115�1118.
227. Szabo C, Ischiropoulos H, Radi R: Peroxydusitan: biochémia,
patofyziológia a vývoj terapeutík. Nat Rev Drug Discov
2007, 6:662�680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmetylfolát
ako doplnková liečba veľkej depresie rezistentnej na SSRI:
výsledky dvoch randomizovaných, dvojito zaslepených, paralelne sekvenčných štúdií. Am J
Psychiatria 2012, 169:1267�1274.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, de Bono J, Lee J, Leeson P,
Neubauer S, Ratnatunga C, Pillai R, Refsum H, Channon KM: 5-
metyltetrahydrofolát rýchlo zlepšuje funkciu endotelu a
znižuje produkciu superoxidu v ľudských cievach: účinky na cievy
dostupnosť tetrahydrobiopterínu a endoteliálna syntáza oxidu dusnatého
spojka. Náklad 2006, 114:1193�1201.
230. Masano T, Kawashima S, Toh R, Satomi-Kobayashi S, Shinohara M, Takaya T,
Sasaki N, Takeda M, Tawa H, Yamashita T, Yokoyama M, Hirata K: Beneficial
účinky exogénneho tetrahydrobiopterínu na remodeláciu ľavej komory
po infarkte myokardu u potkanov: možná úloha oxidačného stresu
spôsobené neviazanou endotelovou syntázou oxidu dusnatého. Circ J 2008,
72: 1512.
231. Alp NJ, Channon KM: Regulácia endotelovej syntázy oxidu dusnatého
tetrahydrobiopterínu pri vaskulárnych ochoreniach. Arterioscler Thromb Vasc Biol 2004,
24: 413.
232. Szymanski S, Ashtari M, Zito J, Degreef G, Bogerts B, Lieberman J:
Gadolínium-DTPA zosilnené gradientové echo magnetické rezonančné skeny v
prvá epizóda psychózy a chronických schizofrenických pacientov.
Psychiatry Res 1991, 40:203�207.
233. Butler T, Weisholtz D, Isenberg N, Harding E, Epstein J, Stern E, Silbersweig
D: Neurozobrazovanie frontálno-limbickej dysfunkcie pri schizofrénii a
psychóza súvisiaca s epilepsiou: smerom ku konvergentnej neurobiológii.
Správanie pri epilepsii 2012, 23:113�122.234. Butler T, Maoz A, Vallabhajosula S, Moeller J, Ichise M, Paresh K, Pervez F,
Friedman D, Goldsmith S, Najjar S, Osborne J, Solnes L, Wang X, French J,
Thesen T, Devinsky O, Kuzniecky R, Stern E, Silbersweig D: Imaging
zápal u pacienta s epilepsiou spojený s protilátkami proti
dekarboxyláza kyseliny glutámovej [abstrakt]. In Am Epilepsy Society Abstracts,
Zväzok 2. Baltimore: American Epilepsy Society; 2011:191.
235. van Berckel BN, Bossong MG, Boellaard R, Kloet R, Schuitemaker A, Caspers
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
Aktivácia mikroglie pri schizofrénii s nedávnym nástupom: kvantitatívna (R)-
Štúdia pozitrónovej emisnej tomografie [11C]PK11195. Biol Psychiatry 2008,
64: 820.
236. Doorduin J, de Vries EF, Willemsen AT, de Groot JC, Dierckx RA, Klein HC:
Neurozápal pri psychóze súvisiacej so schizofréniou: PET štúdia.
J Nucl Med 2009, 50:1801�1807.
237. Takano A, Arakawa R, Ito H, Tateno A, Takahashi H, Matsumoto R, Okubo Y,
Suhara T: Periférne benzodiazepínové receptory u pacientov s chronickou
schizofrénia: PET štúdia s [11C]DAA1106. Int J
Neuropsychopharmacol 2010, 13:943�950.
238. M�ller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, M�ller HJ, Arolt V, Riedel M:
Inhibítor cyklooxygenázy-2 celekoxib má terapeutické účinky v
veľká depresia: výsledky dvojito zaslepeného, randomizovaného placeba
kontrolovaná, doplnková pilotná štúdia k reboxetínu. Mol Psychiatria 2006,
11: 680.
239. Akhondzadeh S, Jafari S, Raisi F, Nasehi AA, Ghoreishi A, Salehi B, MohebbiRasa
S, Raznahan M, Kamalipour A: Klinická skúška adjuvantného celekoxibu
liečba u pacientov s ťažkou depresiou: dvojito zaslepená a
placebom kontrolovaná štúdia. Depress Anxiety 2009, 26:607�611.
240. Mendlewicz J, Kriwin P, Oswald P, Souery D, Alboni S, Brunello N:
Skrátený nástup účinku antidepresív pri užívaní ťažkej depresie
augmentácia kyseliny acetylsalicylovej: pilotná otvorená štúdia. Int Clin
Psychopharmacol 2006, 21:227�231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, Farmer A, McGuffin P:
Nesteroidné protizápalové lieky a účinnosť antidepresív v
veľká depresívna porucha. Psychol Med 2012, 42:2027�2035.
242. M�ller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: Priaznivé antipsychotikum
účinky prídavnej liečby celekoxibom v porovnaní so samotným risperidónom v
schizofrénie. Am J Psychiatry 2002, 159:1029�1034.
243. M�ller N, Riedel M, Schwarz MJ, Engel RR: Klinické účinky COX-2
inhibítory kognície pri schizofrénii. Eur Arch Psychiatry Clin Neurosci
2005, 255:149�151.
244. M�ller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: Liečba celekoxibom v ranom štádiu
štádium schizofrénie: výsledky randomizovanej, dvojito zaslepenej, placebom kontrolovanej
skúšanie augmentácie celekoxibom pri liečbe amisulpridom.
Schizophr Res 2010, 121:118�124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: Predbežný náhodný výber
dvojito zaslepená klinická štúdia o účinnosti celekoxibu ako doplnku pri
liečba obsedantno-kompulzívnej poruchy. Psychiatry Res 2011,
189: 403.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: Metaanalýza účinkov
kyselina eikozapentaénová (EPA) v klinických štúdiách pri depresii. J Clin
Psychiatria 2011, 72:1577�1584.
247. Bloch MH, Hannestad J: Omega-3 mastné kyseliny na liečbu
depresia: systematický prehľad a metaanalýza. Mol Psychiatria 2012,
17: 1272.
248. Keller WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
prehľad protizápalových činidiel na symptómy schizofrénie.
J Psychopharmacol.
249. Warner-Schmidt JL, Vanover KE, Chen EY, Marshall JJ, Greengard P:
Antidepresívne účinky selektívnych inhibítorov spätného vychytávania serotonínu (SSRI)
sú u myší a ľudí oslabené protizápalovými liekmi. Proc Natl
Acad Sci USA 2011, 108:9262�9267.
250. Gallagher PJ, Castro V, Fava M, Weilburg JB, Murphy SN, Gainer VS, Churchill
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: Antidepresívna odpoveď
u pacientov s veľkou depresiou vystavených NSAID: a
farmakovigilančná štúdia. Am J Psychiatry 2012, 169:1065�1072.
251. Shelton RC: Znižuje súčasné užívanie NSAID účinnosť
antidepresíva? Am J Psychiatry 2012, 169:1012�1015.
252. Martinez-Gras I, Perez-Nievas BG, Garcia-Bueno B, Madrigal JL, AndresEsteban
E, Rodriguez-Jimenez R, Hoenická J, Palomo T, Rubio G, Leza JC:
Protizápalový prostaglandín 15d-PGJ2 a jeho jadrový receptor
PPARgama sú znížené pri schizofrénii. Schizophr Res 2011,
128: 15.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: Existuje nejaká úloha pre jadrovú energiu?
receptor PPARgamma pri neuropsychiatrických ochoreniach? Int J
Neuropsychopharmacol 2010, 13:1411�1429.
254. Meyer U: Protizápalová signalizácia pri schizofrénii. Správanie mozgu
Immun 2011, 25:1507�1518.
255. Ramer R, Heinemann K, Merkord J, Rohde H, Salamon A, Linnebacher M,
Hinz B: COX-2 a PPAR-gama spôsobujú apoptózu indukovanú kanabidiolom
ľudských buniek rakoviny pľúc. Mol Cancer Ther 2013, 12:69�82.
256. Henry CJ, Huang Y, Wynne A, Hanke M, Himler J, Bailey MT, Sheridan JF,
Godbout JP: Minocyklín zoslabuje indukciu lipopolysacharidov (LPS).
neurozápal, chorobné správanie a anhedónia.
J Neuroinflammation 2008, 5:15.
257. Sarris J, Mischoulon D, Schweitzer I: Omega-3 pre bipolárnu poruchu: metaanalýzy
použitie pri mánii a bipolárnej depresii. J Clin Psychiatry 2012,
73: 81.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan
SM, Mackinnon A, McGorry PD, Berger GE: Omega-3 mastné kyseliny s dlhým reťazcom
na indikovanú prevenciu psychotických porúch: randomizovaná, placebom kontrolovaná
súdny proces. Arch Gen Psychiatry 2010, 67:146�154.
259. Fusar-Poli P, Berger G: Zásahy kyseliny eikosapentaénovej v r.
schizofrénia: metaanalýza randomizovaných, placebom kontrolovaných štúdií.
J Clin Psychopharmacol 2012, 32:179�185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Neurosteroidy,
stres a depresia: Potenciálne terapeutické príležitosti.
Neurosci Biobehav Rev 2013, 37:109�122.
261. Uhde TW, Singareddy R: Biologický výskum úzkostných porúch. In
Psychiatria ako neuroveda. Editovali Juan Jose LI, Wolfgang G, Mario M,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237�286.
262. Gibson SA, Korado Z, Shelton RC: Oxidačný stres a glutatión
odpoveď v tkanivových kultúrach od osôb s veľkou depresiou.
J Psychiatr Res 2012, 46:1326�1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: Celecoxib ako doplnok pri liečbe
depresívne alebo zmiešané epizódy bipolárnej poruchy: dvojito zaslepená,
randomizovanej, placebom kontrolovanej štúdii. 2008, 23:87�94.
264. Levine J, Cholestoy A, Zimmerman J: Možný antidepresívny účinok
minocyklín. 1996, 153:582.
265. Levkovitz Y, Mendlovich S, Riwkes S, Braw Y, Levkovitch-Verbin H, Gal G,
Fennig S, Treves I, Kron S: Dvojito zaslepená, randomizovaná štúdia
minocyklín na liečbu negatívnych a kognitívnych symptómov v
skorá fáza schizofrénie. J Clin Psychiatry 2010, 71:138�149.
266. Miyaoka T, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Možný antipsychotický účinok minocyklínu u pacientov s
schizofrénie. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304�307.
267. Miyaoka J, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Minocyklín ako prídavná liečba schizofrénie: otvorená štúdia
štúdium. 2008, 31:287�292.
268. Rodriguez CI, Bender J Jr, Marcus SM, Snape M, Rynn M, Simpson HB:
Minocyklínová augmentácia farmakoterapie pri obsedantno-kompulzívnej liečbe
porucha: otvorená štúdia. 2010, 71:1247�1249.
doi:10.1186/1742-2094-10-43
Citujte tento článok ako: Najjar et al.: Neuroinflammation and psychiatric
choroba. Journal of Neuroinflammation 2013 10:43.
Zatvorte akordeón
Informácie tu uvedené o „Neurozápaly a psychiatrické choroby" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka