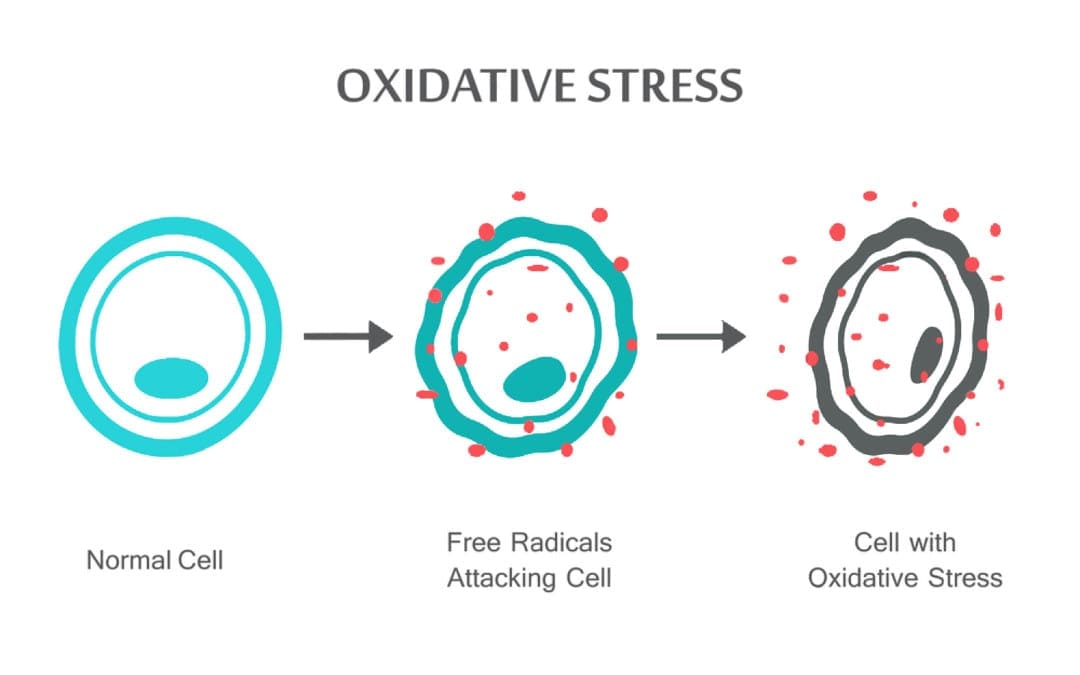
Vedecky založený chiropraktik Dr. Alexander Jimenez sa pozrie na oxidačný stres, čo to je, ako to ovplyvňuje telo a antioxidačnú obranu na nápravu situácie.
Esra Birben PhD, 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 a Omer Kalayci, MD1
Abstrakt: Reaktívne formy kyslíka (ROS) sú produkované živými organizmami v dôsledku normálneho bunkového metabolizmu a environmentálnych faktorov, ako sú látky znečisťujúce ovzdušie alebo cigaretový dym. ROS sú vysoko reaktívne molekuly a môžu poškodiť bunkové štruktúry, ako sú sacharidy, nukleové kyseliny, lipidy a proteíny, a zmeniť ich funkcie. Posun v rovnováhe medzi oxidantmi a antioxidantmi v prospech oxidantov sa nazýva �oxidačný stres.� Regulácia redukčného a oxidačného (redoxného) stavu je rozhodujúca pre životaschopnosť buniek, aktiváciu, proliferáciu a funkciu orgánov. Aeróbne organizmy majú integrované antioxidačné systémy, ktoré zahŕňajú enzymatické a neenzymatické antioxidanty, ktoré sú zvyčajne účinné pri blokovaní škodlivých účinkov ROS. Pri patologických stavoch však môžu byť antioxidačné systémy preťažené. Oxidačný stres prispieva k mnohým patologickým stavom a ochoreniam, vrátane rakoviny, neurologických porúch, aterosklerózy, hypertenzie, ischémie/perfúzie, cukrovky, syndrómu akútnej respiračnej tiesne, idiopatickej pľúcnej fibrózy, chronickej obštrukčnej choroby pľúc a astmy. V tomto prehľade sumarizujeme bunkové oxidačné a antioxidačné systémy a diskutujeme o bunkových účinkoch a mechanizmoch oxidačného stresu.
Kľúčové slová: antioxidant, oxidant, oxidačný stres, reaktívne formy kyslíka, redox
(WAO Journal 2012; 5:9–19)
Reaktívne formy kyslíka (ROS) sú produkované živými organizmami ako výsledok normálneho bunkového metabolizmu. Pri nízkych až stredných koncentráciách fungujú vo fyziologických bunkových procesoch, ale pri vysokých koncentráciách spôsobujú nepriaznivé modifikácie bunkových komponentov, ako sú lipidy, proteíny a DNA.1�6 Posun v rovnováhe medzi oxidantom/antioxidantom v prospech oxidantov sa nazýva �oxidačný stres.� Oxidačný stres prispieva k mnohým patologickým stavom, vrátane rakoviny, neurologických porúch,7�10 aterosklerózy, hypertenzie, ischémie/perfúzie,11�14 cukrovky, syndrómu akútnej respiračnej tiesne, idiopatickej pľúcnej fibrózy, chronickej obštrukčnej choroby pľúc ,15 a astma.16�21 Aeróbne organizmy majú integrované antioxidačné systémy�, ktoré zahŕňajú enzymatické a neenzymatické antioxidanty, ktoré sú zvyčajne účinné pri blokovaní škodlivých účinkov ROS. Pri patologických stavoch však môžu byť antioxidačné systémy preťažené. V tomto prehľade sumarizujeme bunkové oxidačné a antioxidačné systémy a reguláciu redukčného a oxidačného (redoxného) stavu pri zdravotných a chorobných stavoch.
Obsah
OXIDANTY
Endogénne zdroje ROS
ROS sú produkované z molekulárneho kyslíka ako výsledok normálneho bunkového metabolizmu. ROS možno rozdeliť do 2 skupín: voľné radikály a neradikály. Molekuly obsahujúce jeden alebo viac nepárových elektrónov, ktoré molekule poskytujú reaktivitu, sa nazývajú voľné radikály. Keď 2 voľné radikály zdieľajú svoje nepárové elektróny, vytvoria sa neradikálové formy. Tri hlavné ROS, ktoré majú fyziologický význam, sú superoxidový anión (O3.), hydroxylový radikál (OH) a peroxid vodíka (H22O2). ROS sú zhrnuté v tabuľke 2.
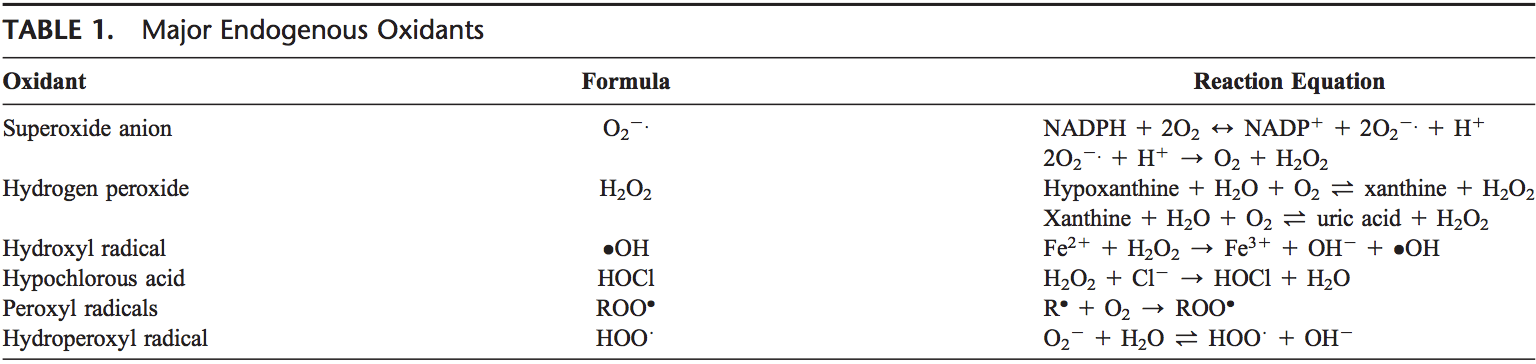
Superoxidový anión vzniká adíciou 1 elektrónu k molekulárnemu kyslíku.22 Tento proces sprostredkúva nikotín adenín dinukleotid fosfát [NAD(P)H] oxidáza alebo xantín oxidáza alebo mitochondriálny elektrónový transportný systém. Hlavným miestom na produkciu superoxidového aniónu sú mitochondrie, mechanizmus bunky na produkciu adenozíntrifosfátu. Normálne sa elektróny prenášajú cez mitochondriálny elektrónový transportný reťazec na redukciu kyslíka na vodu, ale približne 1 až 3 % všetkých elektrónov uniká zo systému a produkuje superoxid. NAD(P)H oxidáza sa nachádza v polymorfonukleárnych leukocytoch, monocytoch a makrofágoch. Po fagocytóze tieto bunky produkujú výbuch superoxidu, ktorý vedie k baktericídnej aktivite. Superoxid sa premieňa na peroxid vodíka pôsobením superoxiddismutáz (SODs, EC 1.15.1.1). Peroxid vodíka ľahko difunduje cez plazmatickú membránu. Peroxid vodíka je tiež produkovaný xantínoxidázou, oxidázou aminokyselín a NAD(P)H oxidázou�23,24 a v peroxizómoch spotrebou molekulárneho kyslíka v metabolických reakciách. V sérii reakcií nazývaných Haber�Weissove a Fentonove reakcie sa H2O2 môže rozložiť na OH2 v prítomnosti transmisných kovov ako Fe21 alebo Cu21.25
Fe31 +�.O2�?Fe2 +�O2 Haber Weiss
Fe2 +�H2O2�?Fe3 +�OH�+ .OH Fentonova reakcia
Samotný O 2 môže tiež reagovať s H2 O2 a vytvárať OH. 26,27 Hydroxylový radikál je najreaktívnejší z ROS a môže poškodiť proteíny, lipidy, sacharidy a DNA. Môže tiež spustiť peroxidáciu lipidov tým, že vezme elektrón z polynenasýtených mastných kyselín.
Granulocytové enzýmy ďalej rozširujú reaktivitu H2O2 prostredníctvom eozinofilnej peroxidázy a myeloperoxidázy (MPO). V aktivovaných neutrofiloch je H2O2 spotrebovaný MPO. V prítomnosti chloridového iónu sa H2O2 premení na kyselinu chlórnu (HOCl). HOCl je vysoko oxidačný a hrá dôležitú úlohu pri ničení patogénov v dýchacích cestách.28 HOCl však môže tiež reagovať s DNA a indukovať interakcie DNA�proteínu a produkovať pyrimidínové oxidačné produkty a pridávať chloridy k bázam DNA.29,30 Eozinofilná peroxidáza a MPO tiež prispievajú k oxidačnému stresu modifikáciou proteínov halogenáciou, nitráciou a zosieťovaním proteínov prostredníctvom tyrozylových radikálov.31�33
Ďalšie voľné radikály odvodené od kyslíka sú peroxylové radikály (ROO$). Najjednoduchšou formou týchto radikálov je hydroperoxylový radikál (HOO$) a zohráva úlohu pri peroxidácii mastných kyselín. Voľné radikály môžu spustiť reťazové reakcie peroxidácie lipidov abstrahovaním atómu vodíka z bočného reťazca metylénového uhlíka. Lipidový radikál potom reaguje s kyslíkom za vzniku peroxylového radikálu. Peroxylový radikál spúšťa reťazovú reakciu a premieňa polynenasýtené mastné kyseliny na lipidové hydroperoxidy. Lipidové hydroperoxidy sú veľmi nestabilné a ľahko sa rozkladajú na sekundárne produkty, ako sú aldehydy (ako je 4-hydroxy-2,3-nonenal) a malondialdehydy (MDA). Izoprostány sú ďalšou skupinou produktov peroxidácie lipidov, ktoré vznikajú peroxidáciou kyseliny arachidónovej a tiež sa zistilo, že sú zvýšené v plazmových a dychových kondenzátoch astmatikov.34,35 Peroxidácia lipidov narúša integritu bunkových membrán a vedie k preskupeniu membránová štruktúra.
Peroxid vodíka, superoxidový radikál, oxidovaný glutatión (GSSG), MDA, izoprostány, karbonyly a nitrotyrozín možno ľahko merať zo vzoriek plazmy, krvi alebo bronchoalveolárnej laváže ako biomarkery oxidácie štandardizovanými testami.
Exogénny zdroj oxidantov
Cigaretový dym
Cigaretový dym obsahuje veľa oxidantov a voľných radikálov a organických zlúčenín, ako sú superoxid a oxid dusnatý.36 Okrem toho vdychovanie cigaretového dymu do pľúc tiež aktivuje niektoré endogénne mechanizmy, ako je akumulácia neutrofilov a makrofágov, ktoré ešte viac zvyšujú oxidačné poškodenie. .
Vystavenie ozónu
Expozícia ozónu môže spôsobiť peroxidáciu lipidov a vyvolať prílev neutrofilov do epitelu dýchacích ciest. Krátkodobá expozícia ozónu tiež spôsobuje uvoľnenie zápalových mediátorov, ako sú MPO, eozinofilné katiónové proteíny a tiež laktátdehydrogenáza a albumín.37 Dokonca aj u zdravých jedincov spôsobuje expozícia ozónu zníženie pľúcnych funkcií.38 Cho et al39 ukázali, že častice (zmes pevných častíc a kvapiek kvapaliny suspendovaných vo vzduchu) katalyzuje redukciu kyslíka.
Hyperoxia
Hyperoxia sa vzťahuje na stavy s vyššími hladinami kyslíka ako je normálny parciálny tlak kyslíka v pľúcach alebo iných telesných tkanivách. Vedie k väčšej produkcii reaktívnych foriem kyslíka a dusíka.40,41
Ionizujúce žiarenie
Ionizujúce žiarenie v prítomnosti O2 premieňa hydroxylové radikály, superoxidy a organické radikály na peroxid vodíka a organické hydroperoxidy. Tieto hydroperoxidové druhy reagujú s redoxne aktívnymi kovovými iónmi, ako je Fe a Cu, prostredníctvom Fentonových reakcií, a tak indukujú oxidačný stres.42,43 Narayanan et al44 ukázali, že fibroblasty, ktoré boli vystavené alfa časticiam, mali významné zvýšenie intracelulárneho O2. a H2O2 produkcia prostredníctvom NADPH oxidázy viazanej na plazmatickú membránu.2 Molekuly prenosu signálu, ako je extracelulárna signálom regulovaná kináza 44 a 1 (ERK2/1), c-Jun N-terminálna kináza (JNK) a p2, a transkripčné faktory, ako napr. aktivátorový proteín-38 (AP-1), jadrový faktor-kB (NF-kB) a p1, sú aktivované, čo vedie k expresii génov súvisiacich s radiačnou odpoveďou.53�45 Ultrafialové A (UVA) fotóny spúšťajú oxidačné reakcie excitáciou endogénnych fotosenzibilizátorov, ako sú porfyríny, NADPH oxidáza a riboflavíny. 50-Oxo-8-dihydroguanín (7,8-oxoGua) je hlavný UVA-sprostredkovaný produkt oxidácie DNA, ktorý vzniká oxidáciou OH radikálu, 8-elektrónových oxidantov a singletového kyslíka, ktorý reaguje hlavne s guanínom.1 Vznik guanínu Ukázalo sa, že radikálový katión v izolovanej DNA sa účinne vyskytuje prostredníctvom priameho účinku ionizujúceho žiarenia.51 Po vystavení ionizujúcemu žiareniu vnútrobunková hladina glutatiónu (GSH) krátkodobo klesá, ale potom sa opäť zvyšuje.52,53
Ióny ťažkých kovov
Ióny ťažkých kovov, ako je železo, meď, kadmium, ortuť, nikel, olovo a arzén, môžu vyvolať tvorbu reaktívnych radikálov a spôsobiť poškodenie buniek prostredníctvom deplécie enzýmových aktivít prostredníctvom peroxidácie lipidov a reakcie s jadrovými proteínmi a DNA.55
Jedným z najdôležitejších mechanizmov vytvárania voľných radikálov sprostredkovaných kovom je reakcia Fentonovho typu. Superoxidový ión a peroxid vodíka môžu interagovať s prechodnými kovmi, ako je železo a meď, prostredníctvom kovom katalyzovanej Haber�Weiss/Fentonovej reakcie za vzniku OH radikálov.
Kov31 1 $O2 /Kov21 1 O2 Haber Weiss Kov21 1 H2 O2 /Kov31 1 OH 2 1 $OH Fentonova reakcia
Okrem mechanizmov Fentonovho typu a Haber-Weissovho typu môžu určité kovové ióny reagovať priamo s bunkovými molekulami za vzniku voľných radikálov, ako sú tiolové radikály, alebo indukovať bunkové signálne dráhy. Tieto radikály môžu tiež reagovať s inými molekulami tiolu za vzniku O22..O22. sa premieňa na H2O2, čo spôsobuje ďalšiu tvorbu kyslíkových radikálov. Niektoré kovy, ako napríklad arzenit, indukujú tvorbu ROS nepriamo aktiváciou systémov produkujúcich radikály v bunkách.56
Arzén je vysoko toxický prvok, ktorý produkuje rôzne ROS, vrátane superoxidu (O2 2), singletového kyslíka (1O2), peroxylového radikálu (ROO ), oxidu dusnatého (NO ), peroxidu vodíka (H2O2) a dimetylarzínových peroxylových radikálov [( CH3)2AsOO ].57�59 Zlúčeniny arzénu (III) môžu inhibovať antioxidačné enzýmy, najmä enzýmy závislé od GSH, ako sú glutatión-S-transferázy (GST), glutatiónperoxidáza (GSH-Px) a GSH reduktáza prostredníctvom väzby - ing na ich sulfhydrylové (�SH) skupiny.60,61
Olovo zvyšuje peroxidáciu lipidov.62 Po expozícii olovom boli zaznamenané významné zníženia aktivity tkanivovej SOD a GPx mozgu.63,64 Nahradenie zinku, ktorý slúži ako kofaktor mnohých enzýmov, olovom, vedie k inaktivácii takýchto enzýmov. Expozícia olova môže spôsobiť inhibíciu GST ovplyvnením tkanivových tiolov.
ROS generované reakciami katalyzovanými kovom môže modifikovať bázy DNA. Tri substitúcie báz, G/C, G/T a C/T, sa môžu vyskytnúť v dôsledku oxidačného poškodenia kovovými iónmi, ako sú Fe21, Cu21 a Ni21. Reid et al65 ukázali, že G/C bol produkovaný prevažne Fe21, zatiaľ čo C/T substitúcia bola Cu21 a Ni21.
ANTIOXIDANTY
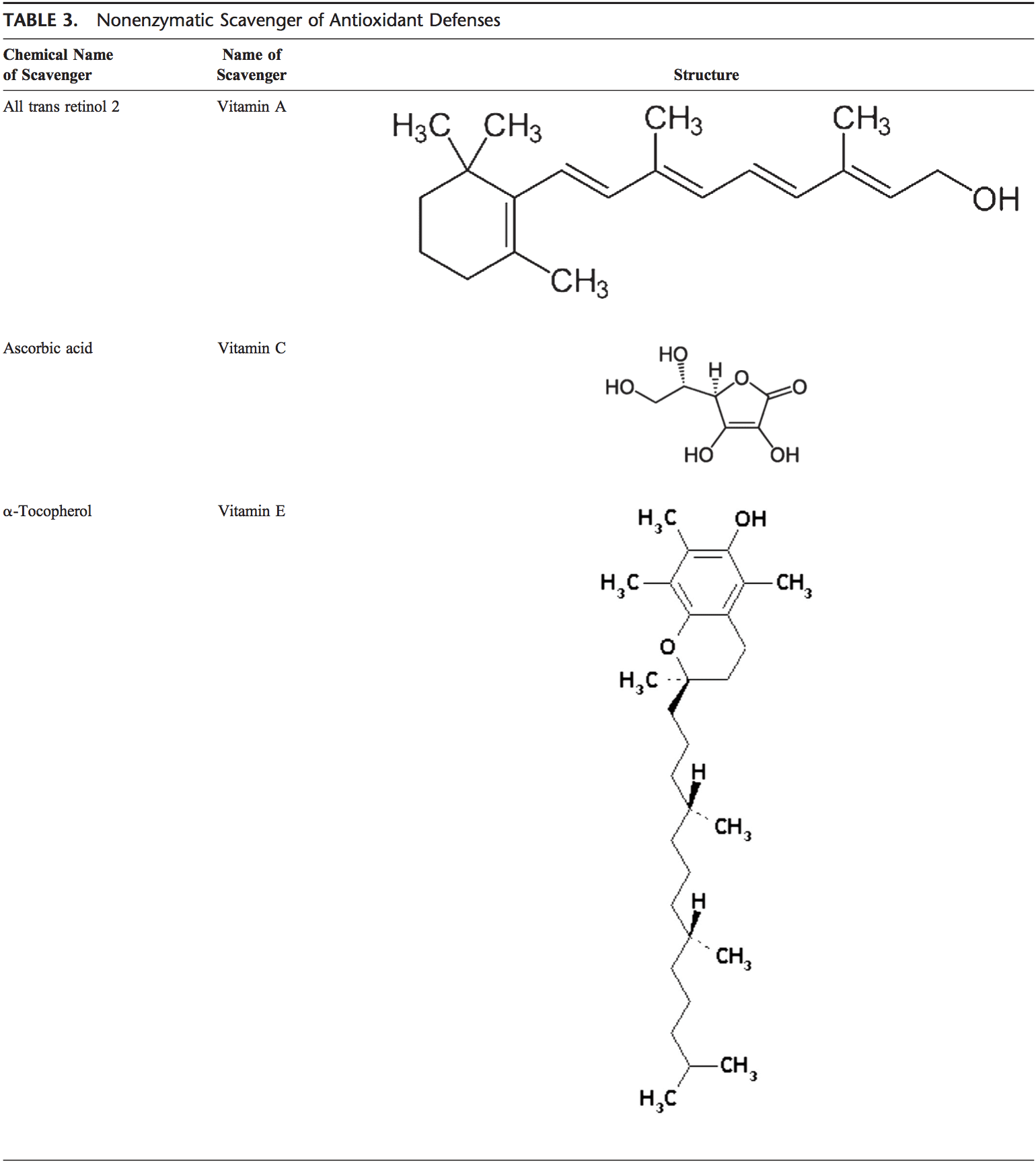
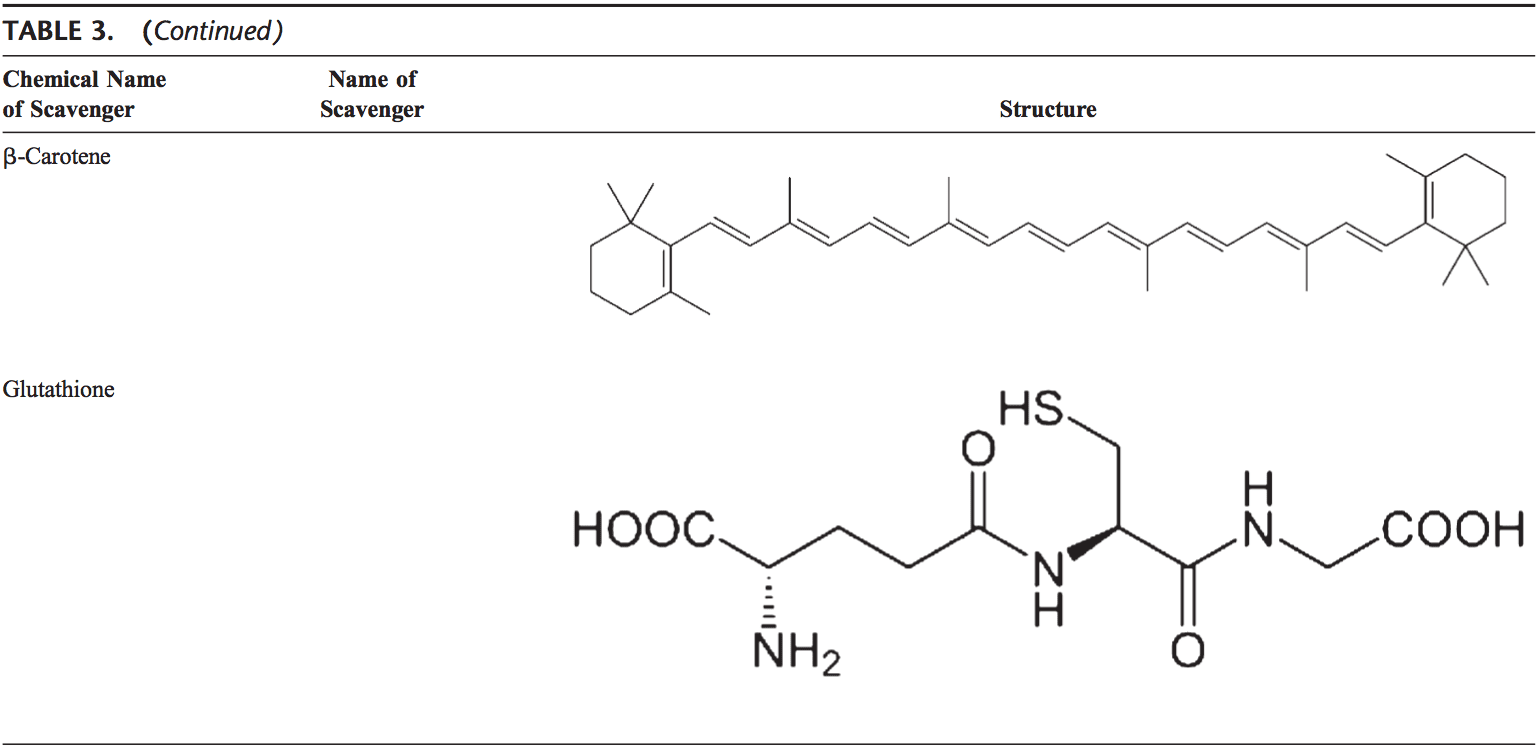
Ľudské telo je vybavené množstvom antioxidantov, ktoré slúžia na vyváženie účinku oxidantov. Pre všetky praktické účely ich možno rozdeliť do 2 kategórií: enzymatické (tabuľka 2) a neenzymatické (tabuľka 3).
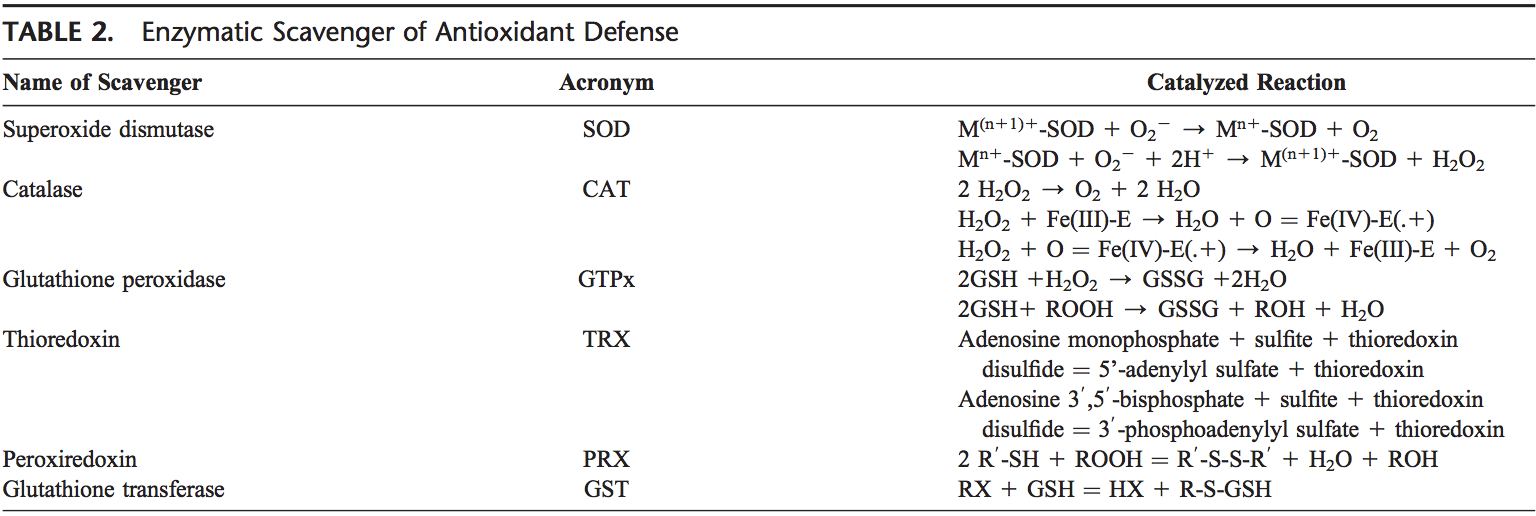
Enzymatické antioxidanty
Hlavné enzymatické antioxidanty pľúc sú SOD (EC 1.15.1.11), kataláza (EC 1.11.1.6) a GSH-Px (EC 1.11.1.9). Okrem týchto hlavných enzýmov, ďalšie antioxidanty, vrátane hemoxygenázy-1 (EC 1.14.99.3) a redoxných proteínov, ako sú tioredoxíny (TRX, EC 1.8.4.10), peroxiredoxíny (PRX, EC 1.11.1.15) a glutaredoxíny Zistilo sa tiež, že hrajú kľúčovú úlohu v pľúcnej antioxidačnej obrane.
Pretože superoxid je primárny ROS produkovaný z rôznych zdrojov, jeho dismutácia pomocou SOD má primárny význam pre každú bunku. Všetky 3 formy SOD, to znamená CuZn-SOD, Mn-SOD a EC-SOD, sú široko exprimované v ľudských pľúcach. Mn-SOD je lokalizovaný v matrici mitochondrií. EC-SOD je primárne lokalizovaný v extracelulárnej matrici, najmä v oblastiach obsahujúcich veľké množstvo kolagénových vlákien typu I a okolo pľúcnych a systémových ciev. Zistilo sa to aj v bronchiálnom epiteli, alveolárnom epiteli a alveolárnych makrofágoch.66,67 Celkovo sa všeobecne predpokladá, že CuZn-SOD a Mn-SOD pôsobia ako veľké lapače superoxidových radikálov. Relatívne vysoká hladina EC-SOD v pľúcach s jej špecifickou väzbou na zložky extracelulárnej matrice môže predstavovať základnú zložku ochrany pľúcnej matrice.68
H2O2, ktorý vzniká pôsobením SOD alebo pôsobením oxidáz, ako je xantínoxidáza, sa katalázou a GSH-Px redukuje na vodu. Kataláza existuje ako tetramér zložený zo 4 rovnakých monomérov, z ktorých každý obsahuje na aktívnom mieste hemovú skupinu. Degradácia H2O2 sa uskutočňuje premenou medzi 2 konformáciami katalázy-ferikatalázy (železo koordinované s vodou) a zlúčeniny I (železo v komplexe s atómom kyslíka). Kataláza tiež viaže NADPH ako redukčný ekvivalent, aby sa zabránilo oxidatívnej inaktivácii enzýmu (tvorbe zlúčeniny II) H2O2, keď sa redukuje na vodu.69
Enzýmy v redoxnom cykle zodpovedné za redukciu H2O2 a lipidových hydroperoxidov (generovaných ako výsledok membránovej lipidovej peroxidácie) zahŕňajú GSH-Pxs.70 GSH-Pxs sú rodinou tetramérnych enzýmov, ktoré obsahujú jedinečnú aminokyselinu selenocysteín v aktívne miesta a používajú tioly s nízkou molekulovou hmotnosťou, ako je GSH, na redukciu H2O2 a peroxidov lipidov na ich zodpovedajúce alkoholy. Boli opísané štyri GSH-Px kódované rôznymi génmi: GSH-Px-1 (bunkový GSH-Px) je všadeprítomný a redukuje peroxidy H2O2 a mastných kyselín, ale nie esterifikované peroxyllipidy.71 Esterifikované lipidy sú redukované membránovo viazaným GSH -Px-4 (fosfolipid hydroperoxid GSH-Px), ktorý môže využívať niekoľko rôznych nízkomolekulárnych tiolov ako redukčné ekvivalenty. GSH-Px-2 (gastrointestinálny GSH-Px) je lokalizovaný v bunkách gastrointestinálneho epitelu, kde slúži na redukciu peroxidov v potrave.72 GSH-Px-3 (extracelulárny GSH-Px) je jediným členom rodiny GSH-Px, ktorý sídli v extracelulárneho kompartmentu a je považovaný za jeden z najdôležitejších extracelulárnych antioxidačných enzýmov u cicavcov. Z nich sa extracelulárny GSH-Px najviac skúma v ľudských pľúcach.73
Okrem toho je likvidácia H2O2 úzko spojená s niekoľkými enzýmami obsahujúcimi tiol, menovite TRX (TRX1 a TRX2), tioredoxín reduktázy (EC 1.8.1.9) (TRR), PRX (čo sú tioredoxín peroxidázy) a glutaredoxíny.74
V ľudských bunkách boli charakterizované dva TRX a TRR, existujúce v cytosóle aj mitochondriách. V pľúcach sú TRX a TRR exprimované v bronchiálnom a alveolárnom epiteli a makrofágoch. V ľudských bunkách sa našlo šesť rôznych PRX, ktoré sa líšia svojou ultraštrukturálnou kompartmentalizáciou. Experimentálne štúdie odhalili dôležitosť PRX VI pri ochrane alveolárneho epitelu. Ľudské pľúca exprimujú všetky PRX v bronchiálnom epiteli, alveolárnom epiteli a makrofágoch.75 Nedávno sa zistilo, že PRX V funguje ako peroxynitritreduktáza,76 čo znamená, že môže fungovať ako potenciálna ochranná zlúčenina pri rozvoji poškodenia pľúc sprostredkovaného ROS .77
Pre tieto antioxidanty je spoločná požiadavka NADPH ako redukčného ekvivalentu. NADPH udržuje katalázu v aktívnej forme a používa sa ako kofaktor TRX a GSH reduktázy (EC 1.6.4.2), ktorá premieňa GSSG na GSH, ko-substrát pre GSH-Pxs. Intracelulárny NADPH sa zase vytvára redukciou NADP1 glukózo-6-fosfátdehydrogenázou, prvým a rýchlosť obmedzujúcim enzýmom pentózofosfátovej dráhy, počas konverzie glukózo-6-fosfátu na 6-fosfoglukonolaktón. Generovaním NADPH je glukózo-6-fosfátdehydrogenáza kritickým determinantom tlmivej kapacity cytosolického GSH (GSH/GSSG), a preto ju možno považovať za nevyhnutný regulačný antioxidačný enzým.78,79
GST (EC 2.5.1.18), ďalšia skupina antioxidačných enzýmov, inaktivuje sekundárne metabolity, ako sú nenasýtené aldehydy, epoxidy a hydroperoxidy. Boli opísané tri hlavné rodiny GST: cytosolická GST, mitochondriálna GST80,81 a mikrozomálna GST spojená s membránou, ktorá má úlohu v metabolizme eikosanoidov a GSH.82 U cicavcov je identifikovaných sedem tried cytosolických GST, označených ako Alpha, Mu, Pi, Sigma, Theta, Omega a Zeta.83�86 Počas nestresových podmienok GST triedy Mu a Pi interagujú s kinázami Ask1 a JNK a inhibujú tieto kinázy.87�89 Ukázalo sa, že GSTP1 disociuje z JNK ako odpoveď na oxidačný stres.89 GSTP1 tiež fyzicky interaguje s PRX VI a vedie k obnoveniu aktivity enzýmu PRX prostredníctvom glutationylácie oxidovaného proteínu.90
Neenzymatické antioxidanty
Neenzymatické antioxidanty zahŕňajú zlúčeniny s nízkou molekulovou hmotnosťou, ako sú vitamíny (vitamíny C a E), b-karotén, kyselina močová a GSH, tripeptid (Lg-glutamyl-L-cysteinyl-L-glycín), ktorý obsahuje tiol ( sulfhydryl) skupina.
Vitamín C (kyselina askorbová)
Vo vode rozpustný vitamín C (kyselina askorbová) poskytuje intracelulárnu a extracelulárnu antioxidačnú kapacitu vo vodnej fáze predovšetkým zachytávaním voľných kyslíkových radikálov. Premieňa voľné radikály vitamínu E späť na vitamín E. Ukázalo sa, že jeho plazmatické hladiny s vekom klesajú.91,92
Vitamín E (a-tokoferol)
Vitamín E rozpustný v lipidoch je koncentrovaný v hydrofóbnom vnútornom mieste bunkovej membrány a je hlavnou obranou proti poškodeniu membrány vyvolanému oxidantmi. Vitamín E daruje elektrón peroxylovému radikálu, ktorý vzniká pri peroxidácii lipidov. a-Tokoferol je najaktívnejšia forma vitamínu E a hlavný membránovo viazaný antioxidant v bunke. Vitamín E spúšťa apoptózu rakovinových buniek a inhibuje tvorbu voľných radikálov.93
Glutatión
GSH je vysoko hojný vo všetkých bunkových kompartmentoch a je hlavným rozpustným antioxidantom. Pomer GSH/GSSG je hlavným determinantom oxidačného stresu. GSH prejavuje svoje antioxidačné účinky niekoľkými spôsobmi.94 Detoxikuje peroxid vodíka a peroxidy lipidov pôsobením GSH-Px. GSH daruje svoj elektrón H2O2, aby ho redukoval na H2O a O2. GSSG je opäť redukovaný na GSH pomocou GSH reduktázy, ktorá využíva NAD(P)H ako donor elektrónov. GSH-Px sú tiež dôležité pre ochranu bunkovej membrány pred peroxidáciou lipidov. Redukovaný glutatión daruje protóny membránovým lipidom a chráni ich pred útokmi oxidantov.95
GSH je kofaktorom niekoľkých detoxikačných enzýmov, ako sú GSH-Px a transferáza. Má úlohu pri premene vitamínu C a E späť na ich aktívne formy. GSH chráni bunky pred apoptózou interakciou s proapoptotickými a antiapoptotickými signálnymi dráhami.94 Reguluje a aktivuje aj niekoľko transkripčných faktorov, ako sú AP-1, NF-kB a Sp-1.
Karotenoidy (b-karotén)
Karotenoidy sú pigmenty nachádzajúce sa v rastlinách. Predovšetkým sa zistilo, že b-karotén reaguje s peroxylovými (ROO), hydroxylovými (OH) a superoxidovými (O22.) radikálmi.96 Karotenoidy vykazujú svoje antioxidačné účinky pri nízkom parciálnom tlaku kyslíka, ale môžu mať prooxidačné účinky pri vyššom kyslíku. koncentrácií.97 Karotenoidy aj kyseliny retinové (RA) sú schopné regulovať transkripčné faktory.98 b-karotén inhibuje oxidantom indukovanú aktiváciu NF-kB a produkciu interleukínu (IL)-6 a tumor nekrotizujúceho faktora-a. Karotenoidy tiež ovplyvňujú apoptózu buniek. Antiproliferatívne účinky RA boli preukázané v niekoľkých štúdiách. Tento účinok RA je sprostredkovaný hlavne receptormi kyseliny retinovej a líši sa medzi typmi buniek. V bunkách karcinómu prsníka sa ukázalo, že receptor kyseliny retinovej spúšťa inhibíciu rastu indukciou zastavenia bunkového cyklu, apoptózy alebo oboch.99,100
ÚČINOK OXIDATÍVNEHO STRESU: GENETICKÉ, FYZIOLOGICKÉ A BIOCHEMICKÉ MECHANIZMY
Oxidačný stres nastáva, keď je rovnováha medzi antioxidantmi a ROS narušená buď v dôsledku vyčerpania antioxidantov alebo akumulácie ROS. Keď nastane oxidačný stres, bunky sa pokúšajú pôsobiť proti oxidačným účinkom a obnoviť redoxnú rovnováhu aktiváciou alebo umlčaním génov kódujúcich obranné enzýmy, transkripčné faktory a štrukturálne proteíny.101,102 Pomer medzi oxidovaným a redukovaným glutatiónom (2GSH/GSSG) je jeden. z dôležitých determinantov oxidačného stresu v organizme. Vyššia produkcia ROS v tele môže zmeniť štruktúru DNA, viesť k modifikácii proteínov a lipidov, aktivácii viacerých stresom indukovaných transkripčných faktorov a produkcii prozápalových a protizápalových cytokínov.
Účinky oxidačného stresu na DNA
ROS môže viesť k modifikáciám DNA niekoľkými spôsobmi, ktoré zahŕňajú degradáciu báz, jedno- alebo dvojvláknové zlomy DNA, purínové, pyrimidínové alebo na cukre viazané modifikácie, mutácie, delécie alebo translokácie a zosieťovanie s proteínmi. Väčšina týchto modifikácií DNA (obr. 1) je vysoko relevantná pre karcinogenézu, starnutie a neurodegeneratívne, kardiovaskulárne a autoimunitné ochorenia. Tabakový dym, redoxné kovy a neredoxné kovy, ako je železo, kadmium, chróm a arzén, sa tiež podieľajú na karcinogenéze a starnutí tým, že vytvárajú voľné radikály alebo sa viažu na tiolové skupiny. Tvorba 8-OH-G je najznámejším poškodením DNA, ku ktorému dochádza prostredníctvom oxidačného stresu a je potenciálnym biomarkerom karcinogenézy.
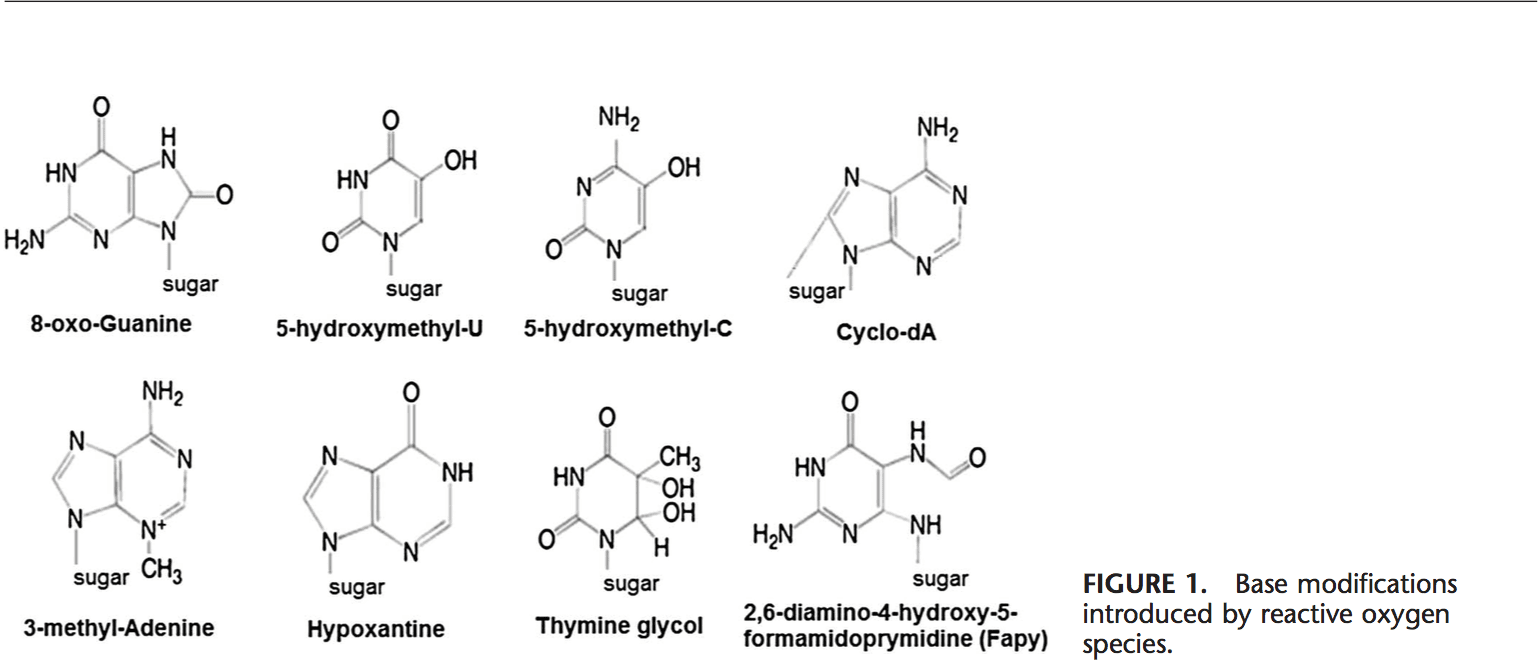
Promótorové oblasti génov obsahujú konsenzuálne sekvencie pre transkripčné faktory. Tieto miesta viažuce transkripčný faktor obsahujú sekvencie bohaté na GC, ktoré sú náchylné na oxidačné útoky. Tvorba 8-OH-G DNA vo väzbových miestach pre transkripčný faktor môže modifikovať väzbu transkripčných faktorov a tak zmeniť expresiu príbuzných génov, ako sa ukázalo pre cieľové sekvencie AP-1 a Sp-1 Okrem 103-OH-G, Ukázalo sa tiež, že 8-cyklo-8,59-deoxyadenozín (cyklo-dA) inhibuje transkripciu z reportérového génu v bunkovom systéme, ak sa nachádza v TATA boxe.29 Proteín viažuci TATA iniciuje transkripciu zmenou ohybu DNA. . Väzba proteínu viažuceho TATA môže byť narušená prítomnosťou cyklo-dA.
Oxidačný stres spôsobuje nestabilitu mikrosatelitných (krátke tandemové opakovania) oblastí. Redoxne aktívne kovové ióny, hydroxylové radikály zvyšujú nestabilitu mikrosatelitov.105 Aj keď zlomy jednovláknovej DNA spôsobené oxidačným poškodením môžu bunky ľahko tolerovať, zlomy dvojvláknovej DNA vyvolané ionizujúcim žiarením môžu byť významnou hrozbou pre prežitie bunky.106
Metylácia na CpG ostrovoch v DNA je dôležitý epigenetický mechanizmus, ktorý môže viesť k umlčaniu génov. Oxidácia 5-MeCyt na 5-hydroxymetyluracil (5-OHMeUra) môže prebiehať prostredníctvom deaminačných/oxidačných reakcií tymínu alebo 5-hydroxymetylcytozínových medziproduktov.107 Zdá sa, že okrem modulácie génovej expresie ovplyvňuje organizáciu chromatínu aj metylácia DNA.108 Aberantné vzory metylácie DNA indukované oxidačnými útokmi tiež ovplyvňujú aktivitu opravy DNA.
Účinky oxidačného stresu na lipidy
ROS môže vyvolať peroxidáciu lipidov a narušiť dvojvrstvové usporiadanie membránových lipidov, ktoré môže inaktivovať receptory a enzýmy viazané na membránu a zvýšiť priepustnosť tkanív.109 Produkty peroxidácie lipidov, ako sú MDA a nenasýtené aldehydy, sú schopné inaktivovať mnohé bunkové proteíny vytvorením proteínového kríža. -väzby.110�112 4-Hydroxy-2-nonenal spôsobuje depléciu intracelulárneho GSH a vyvoláva produkciu peroxidu,113,114 aktivuje receptor epidermálneho rastového faktora,115 a indukuje produkciu fibronektínu.116 Produkty peroxidácie lipidov, ako sú izoprostany a látky retiobarbiturovej kyseliny , boli použité ako nepriame biomarkery oxidačného stresu a zvýšené hladiny sa ukázali v kondenzáte vydychovaného dychu alebo tekutine z bronchoalveolárnej laváže alebo pľúcach pacientov s chronickou obštrukčnou chorobou pľúc alebo fajčiarov.117�119
Účinky oxidačného stresu na bielkoviny
ROS môže spôsobiť fragmentáciu peptidového reťazca, zmenu elektrického náboja proteínov, zosieťovanie proteínov a oxidáciu špecifických aminokyselín, a preto vedie k zvýšenej náchylnosti k proteolýze degradáciou špecifickými proteázami.120 Cysteínové a metionínové zvyšky v proteínoch sú obzvlášť náchylné na oxidáciu.121 Oxidácia sulfhydrylových skupín alebo metionínových zvyškov proteínov spôsobuje konformačné zmeny, rozklad proteínov a degradáciu.8,121�123 Enzýmy, ktoré majú kovy na svojich aktívnych miestach alebo blízko nich, sú obzvlášť citlivejšie na oxidáciu katalyzovanú kovom. Ukázalo sa, že oxidačná modifikácia enzýmov inhibuje ich aktivity.124,125
V niektorých prípadoch môže dôjsť k špecifickej oxidácii proteínov. Napríklad metionín môže byť oxidovaný metionínsulfoxid126 a fenylalanín na o-tyrozín127; sulfhydrylové skupiny môžu byť oxidované za vzniku disulfidových väzieb;128 a karbonylové skupiny môžu byť zavedené do bočných reťazcov proteínov. Gama lúče, kovom katalyzovaná oxidácia, HOCl a ozón môžu spôsobiť tvorbu karbonylových skupín.129
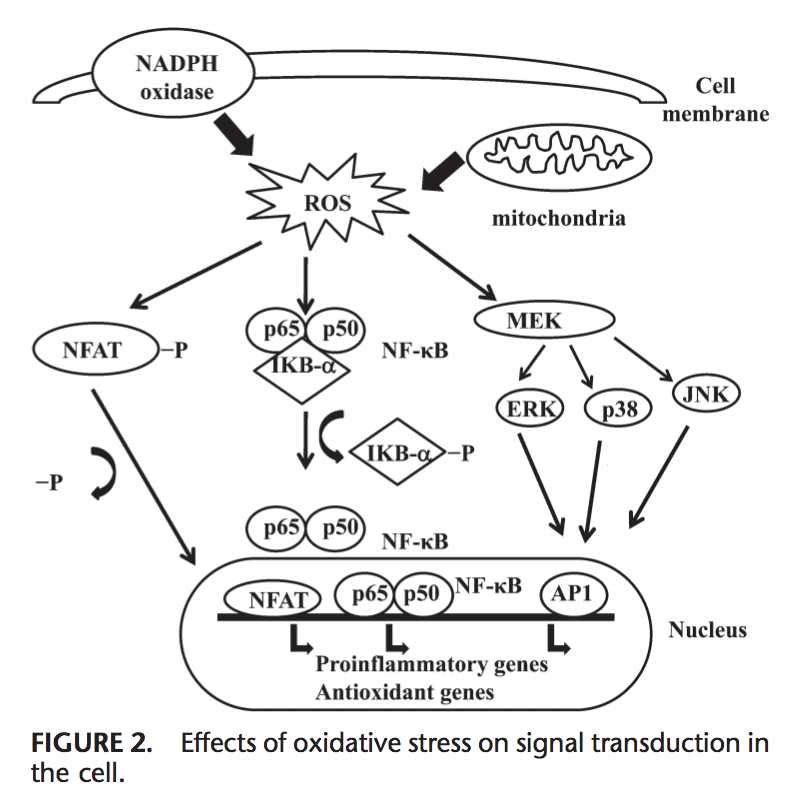
Účinky oxidačného stresu na prenos signálu
ROS môže indukovať expresiu niekoľkých génov zapojených do signálnej transdukcie.1,130 Vysoký pomer GSH/GSSG je dôležitý pre ochranu bunky pred oxidačným poškodením. Narušenie tohto pomeru spôsobuje aktiváciu redox citlivých transkripčných faktorov, ako sú NF-kB, AP-1, jadrový faktor aktivovaných T buniek a hypoxiou indukovateľný faktor 1, ktoré sa podieľajú na zápalovej odpovedi. Aktivácia transkripčných faktorov prostredníctvom ROS je dosiahnutá signálnymi transdukčnými kaskádami, ktoré prenášajú informácie zvonku do vnútra bunky. Receptory tyrozínkinázy, väčšina receptorov rastového faktora, ako je receptor epidermálneho rastového faktora, receptor vaskulárneho endotelového rastového faktora a receptor pre rastový faktor odvodený od krvných doštičiek, proteín tyrozínfosfatázy a serín/treonínkinázy sú cieľmi ROS.131�133 Kinázy regulované extracelulárnym signálom, JNK a p38, ktoré sú členmi rodiny mitogénom aktivovaných proteínkináz a podieľajú sa na niekoľkých procesoch v bunke vrátane proliferácie, diferenciácie a apoptózy, môžu byť tiež regulované oxidantmi.
V podmienkach oxidačného stresu cysteínové zvyšky vo väzbovom mieste DNA c-Jun, niektoré podjednotky AP-1 a inhibičná kB kináza podliehajú reverzibilnej S-glutatiolácii. Uvádza sa, že glutaredoxín a TRX hrajú dôležitú úlohu v regulácii redox-senzitívnych signálnych dráh, ako sú NF-kB a AP-1, mitogénom aktivovaná proteínkináza p38 a JNK.134�137
NF-kB sa môže aktivovať v reakcii na podmienky oxidačného stresu, ako sú ROS, voľné radikály a UV žiarenie.138 Fosforylácia IkB uvoľňuje NF-kB a umožňuje mu vstúpiť do jadra, aby sa aktivovala génová transkripcia.139 Množstvo kináz má bolo hlásené, že fosforyluje IkB na serínových zvyškoch. Tieto kinázy sú cieľom oxidačných signálov na aktiváciu NF-kB.140 Redukčné činidlá zvyšujú väzbu NF-kB na DNA, zatiaľ čo oxidačné činidlá inhibujú väzbu DNA na NF-kB. TRX môže vykonávať 2 opačné účinky pri regulácii NF-kB: v cytoplazme blokuje degradáciu IkB a inhibuje aktiváciu NF-kB, ale zvyšuje väzbu NF-kB DNA v jadre.141 Aktivácia NF-kB prostredníctvom degradácie súvisiacej s oxidáciou IkB vedie k aktivácii niekoľkých génov súvisiacich s antioxidačnou obranou. NF-kB reguluje expresiu niekoľkých génov, ktoré sa podieľajú na imunitnej odpovedi, ako sú IL-1b, IL-6, tumor nekrotizujúci faktor-a, IL-8 a niekoľko adhéznych molekúl.142,143 NF-kB tiež reguluje angiogenézu a proliferáciu a diferenciácia buniek.
AP-1 je tiež regulovaný redoxným stavom. V prítomnosti H2O2 môžu niektoré kovové ióny indukovať aktiváciu AP-1. Zvýšenie pomeru GSH/GSSG zvyšuje väzbu AP-1, zatiaľ čo GSSG inhibuje väzbu DNA AP-1.144 Väzba DNA heterodiméru Fos/Jun sa zvyšuje redukciou jedného konzervovaného cysteínu v doméne viažucej DNA každého z proteíny145, zatiaľ čo väzba DNA AP-1 môže byť inhibovaná GSSG v mnohých typoch buniek, čo naznačuje, že tvorba disulfidových väzieb cysteínovými zvyškami inhibuje väzbu DNA AP-1 Prenos signálu prostredníctvom oxidačného stresu je zhrnutý na obrázku 146,147.
záver
Oxidačný stres môže vzniknúť z nadprodukcie ROS metabolickými reakciami, ktoré využívajú kyslík a posúvajú medzi nimi rovnováhu oxidant/antioxidant stavy v prospech oxidantov. ROS sú produkované bunkovými metabolickými aktivitami a environmentálnymi faktormi, ako sú látky znečisťujúce ovzdušie alebo cigaretový dym. ROS sú vysoko reaktívne molekuly kvôli nespárovaným elektrónom vo svojej štruktúre a reagujú s niekoľkými biologickými makromolekulami v bunke, ako sú sacharidy, nukleové kyseliny, lipidy a proteíny, a menia svoje funkcie. ROS tiež ovplyvňuje expresiu niekoľkých génov upreguláciou redox-senzitívnych transkripčných faktorov a remodeláciou chromatínu prostredníctvom zmeny v acetylácii / deacetylácii histónov. Regulácia redoxného stavu je rozhodujúca pre životaschopnosť buniek, aktiváciu, proliferáciu a funkciu orgánov.
REFERENCIE
1. Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. Voľné radikály, kovy a antioxidanty pri rakovine vyvolanej oxidačným stresom. Chem Biol Interact. 2006;160:1�40.
2. Halliwell B, Gutteridge JMC. Voľné radikály v biológii a medicíne. 3. vyd. New York: Oxford University Press;1999.
3. Marnett LJ. Peroxidácia lipidov a poškodenie DNA malondialdehydom. Mutat Res. 1999;424:83�95.
4. Siems WG, Grune T, Esterbauer H. Tvorba 4-hydroxynonenalu počas ischémie a reperfúzie tenkého čreva potkana. �Life Sci. 1995;57:785�789.
5. Stadtman ER. Úloha druhov oxidantov pri starnutí. Curr Med Chem. 2004;11:1105�1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Predpokladané malondialdehydové adukty DNA v tkanivách ľudského prsníka indukované peroxidáciou lipidov. Biomarkery epidemiolu rakoviny Predch. 1996;5:705�710.
7. Jenner P. Oxidačný stres pri Parkinsonovej chorobe. Ann Neurol. 2003;53: S26�S36.
8. Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. Hodnotenie oxidačného poškodenia proteínov, lipidov a DNA v mozgu od pacientov s Alzheimerovou chorobou. J Neurochem. 1997;68:2061�2069.
9. Sayre LM, Smith MA, Perry G. Chémia a biochémia oxidačného stresu pri neurodegeneratívnom ochorení. Curr Med Chem. 2001;8:721�738.
10. Toshniwal PK, Zarling EJ. Dôkaz zvýšenej peroxidácie lipidov pri roztrúsenej skleróze. Neurochem Res. 1992;17:205�207.
11. Dhalla NS, Temsah RM, Netticadan T. Úloha oxidačného stresu pri kardiovaskulárnych ochoreniach. J Hypertens. 2000;18:655�673.
12. Kašparová S, Brezová V, Valko M, Horecký J, Mlynárik V, et al. Štúdia oxidačného stresu na potkanom modeli chronickej hypoperfúzie mozgu. Neurochem Int. 2005;46:601�611.
13. Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. Produkcia superoxidových aniónov je zvýšená v modeli genetickej hypertenzie: úloha endotelu. Hypertenzia. 1999;33:1353�1358.
14. Kukreja RC, Hess ML. Systém voľných radikálov kyslíka: od rovníc cez interakcie membránových proteínov až po kardiovaskulárne poškodenie a ochranu. Cardiovasc Res. 1992;26:641�655.
15. Asami S, Manabe H, Miyake J, Tsurudome Y, Hirano T, a kol. Fajčenie cigariet vyvoláva zvýšenie oxidačného poškodenia DNA, 8-hydroxydeoxyguanozín, v centrálnom mieste ľudských pľúc. Karcinogenéza. 1997;18:1763�1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Oxidačné a nitrozatívne udalosti pri astme. Free Radic Biol Med. 2003;35:213�225.
17. Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. Korelácia systémového deficitu superoxiddismutázy s obštrukciou prietoku vzduchu pri astme. Am J Respir Crit Care Med. 2005;172:306�313.
18. Comhair SA, Xu W, Ghosh S, Thunnissen FB, Almasan A, a kol. Inaktivácia superoxiddismutázy v patofyziológii prestavby a reaktivity astmatických dýchacích ciest. Am J Pathol. 2005;166:663�674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Oxidačný stres a jeho determinanty v dýchacích cestách detí s astmou. Alergia. 2008;63:1605�1609.
20. Ercan H, Birben E, Dizdar EA, Keskin O, Karaaslan C, a kol. Oxidačný stres a genetické a epidemiologické determinanty oxidačného poškodenia u detskej astmy. J Allergy Clin Immunol. 2006;118:1097�1104.
21. Fitzpatrick AM, Teague WG, Holguin F, Yeh M, Brown LA. Program výskumu ťažkej astmy. Homeostáza glutatiónu v dýchacích cestách je u detí s ťažkou astmou zmenená: dôkaz oxidačného stresu. J Allergy Clin Immunol. 2009;123:146�152.
22. Miller DM, Buettner GR, Aust SD. Prechodné kovy ako katalyzátory „autooxidačných“ reakcií. Free Radic Biol Med. 1990;8:95�108.
23. Dupuy C, Virion A, Ohayon R, Kaniewski J, D�me D, Pommier J. Mechanizmus tvorby peroxidu vodíka katalyzovaný NADPH oxidázou v plazmatickej membráne štítnej žľazy. J Biol Chem. 1991;266:3739�3743.
24. Grangerová DN. Úloha xantínoxidázy a granulocytov pri ischemiareperfúznom poškodení. Am J Physiol. 1988;255:H1269�H1275.
25. Fenton HJH. Oxidácia kyseliny vínnej v prítomnosti železa. J Chem Soc. 1984;65:899�910.
26. Haber F, Weiss JJ. Katalytický rozklad peroxidu vodíka soľami železa. Proc R Soc Lond Ser A. 1934;147:332�351.
27. Liochev SI, Fridovič I. Haber�Weiss na bicykli o 70 rokov neskôr: alternatívny pohľad. Redox Rep. 2002;7:55�57.
28. Klebanoff SJ. Myeloperoxidáza: priateľ a nepriateľ. J Leukoc Biol. 2005;77:598�625.
29. Whiteman M, Jenner A, Halliwell B. Modifikácie báz indukované kyselinou chlórnou v izolovanej DNA teľacieho týmusu. Chem Res Toxicol. 1997;10:1240�1246.
30. Kulcharyk PA, Heinecke JW. Kyselina chlórna produkovaná myeloperoxidázovým systémom ľudských fagocytov indukuje kovalentné krížové väzby medzi DNA a proteínom. Biochémia. 2001;40:3648�3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W a kol. Príbeh dvoch kontroverzií: definovanie úlohy peroxidáz pri tvorbe nitrotyrozínu in vivo pomocou eozinofilnej peroxidázy a myší s deficitom myeloperoxidázy a povahy reaktívnych druhov dusíka generovaných peroxidázou. J Biol Chem. 2002;277:17415�17427.
32. Denzler KL, Borchers MT, Crosby JR, Cieslewicz G, Hines EM a kol. Rozsiahla degranulácia eozinofilov a peroxidázou sprostredkovaná oxidácia proteínov dýchacích ciest sa nevyskytujú v myšom modeli pľúcneho zápalu s výzvou ovalbumínu. J Immunol. 2001;167:1672�1682.
33. van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. Dusitany ako substrát a inhibítor myeloperoxidázy. Dôsledky pre nitráciu a produkciu kyseliny chlórnej v miestach zápalu. J Biol Chem. 2000;275:11638�11644.
34. Drevo LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. Peroxidácia lipidov stanovená izoprostánmi v plazme súvisí so závažnosťou ochorenia pri miernej astme. Lipidy. 2000;35:967�974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Zvýšený 8-izoprostán, marker oxidačného stresu, vo vydychovanom kondenzáte pacientov s astmou. Am J Respir Crit Care Med. 1999;160:216�220.
36. Church DF, Pryor WA. Voľná radikálová chémia cigaretového dymu a jej toxikologické dôsledky. Environmentálny zdravotný výhľad. 1985;64:111�126.
37. Hiltermann JT, Lapperre TS, van Bree L, Steerenberg PA, Brahim JJ a kol. Zápal vyvolaný ozónom hodnotený v spúte a tekutine z výplachu priedušiek od astmatikov: nový neinvazívny nástroj v epidemiologických štúdiách znečistenia ovzdušia a astmy. Free Radic Biol Med. 1999;27:1448�1454.
38. Slávik JA, Rogers DF, Barnes PJ. Účinok inhalovaného ozónu na vydychovaný oxid dusnatý, funkciu pľúc a indukovaný spút u normálnych a astmatických jedincov. Hrudník. 1999;54:1061�1069.
39. Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA a kol. Redoxná aktivita polietavých častíc na rôznych miestach v povodí Los Angeles. Environ Res. 2005;99:40�47.
40. Comhair SA, Thomassen MJ, Erzurum SC. Diferenciálna indukcia extracelulárnej glutatiónperoxidázy a syntázy oxidu dusnatého 2 v dýchacích cestách zdravých jedincov vystavených 100 % O(2) alebo cigaretovému dymu. Am J Respir Cell Mol Biol. 2000;23:350�354.
41. Matthay MA, Geiser T, Matalon S, Ischiropoulos H. Oxidantom sprostredkované poškodenie pľúc pri syndróme akútnej respiračnej tiesne. Crit Care Med. 1999;27:2028�2030.
42. Biaglow JE, Mitchell JB, Held K. Význam peroxidu a superoxidu v röntgenovej reakcii. Int J Radiat Oncol Biol Phys. 1992;22:665�669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. Senzibilizácia miest pripojenia jadrovej matrice na ionizujúce žiarenie sprostredkovaná iónmi medi. Biochémia. 1993;32:6214�6219.
44. Narayanan PK, Goodwin EH, Lehnert BE. Alfa častice iniciujú biologickú produkciu superoxidových aniónov a peroxidu vodíka v ľudských bunkách. Cancer Res. 1997;57:3963�3971.
45. Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. Citlivosť na chemické oxidanty a žiarenie v CHO bunkových líniách s nedostatkom aktivity oxidačného pentózového cyklu. Int J Radiat Oncol Biol Phys. 1992;22: 671�675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D a kol. mangán
expresia génu sprostredkovaná superoxiddismutázou pri ožarovaní
adaptívne reakcie. Mol Cell Biol. 2003;23:2362�2378.
47. Azzam EI, de Toledo SM, Spitz DR, Little JB. Oxidačný metabolizmus
moduluje prenos signálu a tvorbu mikrojadier u okoloidúcich
bunky z normálnych ľudských fibroblastov ožiarených a-časticami. Cancer Res.
2002;62:5436�5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Ionizujúce žiarenie indukované, na mitochondriách závislé generovanie reaktívneho
kyslík/dusík. Cancer Res. 2001;61:3894�3901.
49. Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK cesty v r.
radiačné reakcie. Onkogén. 2003;22:5885�5896.
50. Wei SJ, Botero A, Hirota K, Bradbury CM, Markovina S, et al. Thioredoxin
jadrová translokácia a interakcia s redoxným faktorom-1 aktivuje transkripčný faktor AP-1 v reakcii na ionizujúce žiarenie. Cancer Res. 2000;60:6688�6695.
51. Kadet J, Douki T, Gasparutto D, Ravanat JL. Oxidačné poškodenie DNA: tvorba, meranie a biochemické vlastnosti. Mutat Res. 2003;531:5�23.
52. Yokoya A, Cunniffe SM, O�Neill P. Vplyv hydratácie na indukciu zlomov vlákien a lézií báz vo filmoch plazmidovej DNA gamažiarením. J Am Chem Soc. 2002;124:8859�8866.
53. Janssen YM, Van Houten B, Borm PJ, Mossman BT. Reakcie buniek a tkanív na oxidačné poškodenie. Lab Invest. 1993;69:261�274.
54. Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. Indukcia gama glutamylcysteínsyntetázy ionizujúcim žiarením v bunkách ľudského glioblastómu T98G závislá od jadrového faktora kappa B. Free Radic Biol Med. 1998;24:1256�1268.
55. Stohs SJ, Bagchi D. Oxidačné mechanizmy v toxicite kovových iónov. Free Radic Biol Med. 1995;18:321�336.
56. Leonard SS, Harris GK, Shi X. Kovom indukovaný oxidačný stres a prenos signálu. Free Radic Biol Med. 2004;37:1921�1942.
57. Shi H, Shi X, Liu KJ. Oxidačný mechanizmus toxicity arzénu a karcinogenéza. Mol Cell Biochem. 2004;255:67�78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Potenciálny mechanizmus narušenia tvorby oxidu dusnatého spôsobeného predĺženým orálnym vystavením arzenátu u králikov. Free Radic Biol Med.2003;35:102�113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. Zlomy DNA reťazca vyvolané kyselinou dimetylarzínovou, metabolitom anorganického arzénu, sú silne zosilnené superoxidovými aniónovými radikálmi. Biol Pharm Bull. 1995;18:45�58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. Mechanizmy, ktoré sú základom karcinogenézy arzénu: precitlivenosť myší vystavených anorganickému arzénu počas tehotenstva. Toxikológia. 2004;198:31�38.
61. Schiller CM, Fowler BA, Woods JS. Účinky arzénu na aktiváciu pyruvátdehydrogenázy. Environmentálny zdravotný výhľad. 1977;19:205�207.
62. Monterio HP, Bechara EJH, Abdalla DSP. Účasť voľných radikálov na neurologických porfýriách a otravách olovom. Mol Cell Biochem. 1991;103:73�83.
63. Tripathi RM, Raghunath R, Mahapatra S. Krvné olovo a jeho vplyv na hladiny Cd, Cu, Zn, Fe a hemoglobínu u detí. Sci Total Environ. 2001;277:161�168.
64. Nehru B, Dua R. Vplyv dietetického selénu na neurotoxicitu olova. J Environ Pathol Toxicol Oncol. 1997;16:47�50.
65. Reid TM, Feig DI, Loeb LA. Mutagenéza kovmi indukovanými kyslíkovými radikálmi. Environmentálny zdravotný výhľad. 1994;102(dodatok 3):57�61.
66. Kinnula VL, Crapo JD. Superoxiddismutázy v pľúcach a ľudských pľúcnych ochoreniach. Am J Respir Crit Care Med. 2003;167:1600�1619.
67. Kinnula VL. Produkcia a degradácia metabolitov kyslíka počas zápalových stavov v ľudských pľúcach. Curr Drug Targets Inflamm Allergy. 2005;4:465�470.
68. Zelko IN, Mariani TJ, Folz RJ. Multigénová rodina superoxiddismutázy: porovnanie štruktúr, evolúcie a expresie génov CuZn-SOD (SOD1), Mn-SOD (SOD2) a EC-SOD (SOD3). Free Radic Biol Med. 2002;33:337�349.
69. Kirkman HN, Rolfo M, Ferraris AM, Gaetani GF. Mechanizmy ochrany katalázy pomocou NADPH. Kinetika a stechiometria. J Biol Chem. 1999;274:13908�13914.
70. Floh� L. Glutatiónperoxidáza. Basic Life Sci. 1988;49:663�668.
71. Arthur JR. Glutatiónperoxidázy. Cell Mol Life Sci. 2000;57:1825�1835.
72. Chu FF, Doroshow JH, Esworthy RS. Expresia, charakterizácia a tkanivová distribúcia novej bunkovej glutatiónperoxidázy závislej od selénu, GSHPx-GI. J Biol Chem. 1993;268:2571�2576.
73. Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. Indukcia extracelulárnej glutatiónperoxidázy v astmatických pľúcach: dôkaz redoxnej regulácie expresie v ľudských epiteliálnych bunkách dýchacích ciest. FASEB J. 2001;15:70�78.
74. Gromer S, Urig S, Becker K. Tioredoxínový systém od vedy po kliniku. Med Res Rev. 2004;24:40-89.
75. Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R, Lakari E, P��kk� P, et al. Bunková špecifická expresia peroxiredoxínov v ľudskej pľúcnej a pľúcnej sarkoidóze. Hrudník. 2002;57:157�164.
76. Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T a kol. Ľudský peroxiredoxín 5 je peroxynitritreduktáza. FEBS Lett. 2004;571:161�165.
77. Holmgren A. Antioxidačná funkcia tioredoxínových a glutaredoxínových systémov. Antioxidačný redoxný signál. 2000;2:811�820.
78. Dickinson DA, Forman HJ. Glutatión v obrane a signalizácii: lekcie od malého tiolu. Ann NY Acad Sci. 2002;973:488�504.
79. Sies H. Glutatión a jeho úloha v bunkových funkciách. Free Radic Biol Med. 1999;27:916�921.
80. Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Paralelné evolučné dráhy pre glutatión transferázy: štruktúra a mechanizmus mitochondriálneho enzýmu triedy kappa rGSTK1-1. Biochémia. 2004;43:52�61.
81. Robinson A, Huttley GA, Booth HS, Board PG. Modelovanie a bioinformatické štúdie ľudskej glutatión transferázy triedy kappa predpovedajú novú tretiu rodinu transferáz s homológiou s prokaryotickými 2-hydroxychromen-2-karboxylát izomerázami. Biochem J. 2004;379:541�552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Spoločné štrukturálne znaky rozšírenej superrodiny proteínov spojených s membránou MAPEGda s vysoko odlišnými funkciami v metabolizme eikosanoidov a glutatiónu. Protein Sci. 1999;8:689�692.
83. Hayes JD, Pulford DJ. Rodina supergénu glutatión S-transferázy: regulácia GST a príspevok izoenzýmov k chemoprotekcii rakoviny a rezistencii voči liekom. Crit Rev Biochem Mol Biol. 1995;30:445�600.
84. Armstrong RN. Štruktúra, katalytický mechanizmus a vývoj glutatión transferáz. Chem Res Toxicol. 1997;10:2-18.
85. Hayes JD, McLellan LI. Glutatión a enzýmy závislé od glutatiónu predstavujú koordinovane regulovanú obranu proti oxidačnému stresu. Free Radic Res. 1999;31:273�300.
86. Sheehan D, Meade G, Foley VM, Dowd CA. Štruktúra, funkcia a vývoj glutatión transferáz: dôsledky pre klasifikáciu necicavčích členov starodávnej nadrodiny enzýmov. Biochem J. 2001;360:1-16.
87. Cho SG, Lee YH, Park HS, Ryoo K, Kang KW a kol. Glutatión S-transferáza Mu moduluje stresom aktivované signály potlačením kinázy 1 regulujúcej signál apoptózy. J Biol Chem. 2001;276:12749�12755.
88. Dorion S, Lambert H, Landry J. Aktivácia signálnej dráhy p38 tepelným šokom zahŕňa disociáciu glutatión S-transferázy Mu z Ask1. J Biol Chem. 2002;277:30792�30797.
89. Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L a kol. Regulácia signalizácie JNK pomocou GSTp. EMBO J. 1999;18:1321�1334.
90. Manevich Y, Feinstein SI, Fisher AB. Aktivácia antioxidačného enzýmu 1-CYS peroxiredoxínu vyžaduje glutationyláciu sprostredkovanú heterodimerizáciou s pGST. Proc Natl Acad Sci USA 2004;101:3780�3785.
91. Bunker VW. Voľné radikály, antioxidanty a starnutie. Med Lab Sci. 1992;49:299�312.
92. Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD a kol. Systémový oxidačný stres a jeho vzťah s vekom a chorobou. J Am Geriatr Soc. 1996;44:823�827.
93. White E, Shannon JS, Patterson RE. Vzťah medzi vitamínom a
užívanie doplnkov vápnika a rakovina hrubého čreva. Biomarkery epidemiolu rakoviny Predch. 1997;6:769�774.
94. Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Nové mechanizmy prírodných antioxidačných zlúčenín v biologických systémoch: účasť glutatiónu a enzýmov súvisiacich s glutatiónom. J Nutr Biochem. 2005;16:577�586.
95. Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. Zmeny stavu srdcového glutatiónu po ischémii a reperfúzii. Skúsenosti. 1985;41:42-43.
96. El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. Chémia karotenoidových radikálov a antioxidačné/prooxidačné vlastnosti. Arch Biochem Biophys. 2004;430:37�48.
97. Rice-Evans CA, Sampson J, Bramley PM, Holloway DE. Prečo očakávame, že karotenoidy budú antioxidanty in vivo? Free Radic Res. 1997;26:381�398.
98. Niles RM. Signálne dráhy v retinoidnej chemoprevencii a liečbe rakoviny. Mutat Res. 2004;555:81�96.
99. Donato LJ, Noy N. Potlačenie rastu karcinómu prsníka kyselinou retinovou: proapoptotické gény sú cieľmi pre signalizáciu receptora kyseliny retinovej a bunkovej signalizácie proteínu II viažuceho kyselinu retinovú. Cancer Res. 2005;65:8193�8199.
100. Niizuma H, Nakamura Y, Ozaki T, Nakanishi H, Ohira M a kol. Bcl-2 je kľúčový regulátor pre apoptotickú bunkovú smrť indukovanú kyselinou retinovou pri neuroblastóme. Onkogén. 2006;25:5046�5055.
101. Dalton TP, Shertzer HG, Puga A. Regulácia génovej expresie reaktívnym kyslíkom. Ann Rev Pharmacol Toxicol. 1999;39:67�101.
102. Scandalios JG. Genomické reakcie na oxidačný stres. In: Meyers RA, ed. Encyklopédia molekulárnej bunkovej biológie a molekulárnej medicíny. Vol 5. 2nd ed. Weinheim, Nemecko: Wiley-VCH; 2004: 489�512.
103. Ghosh R, Mitchell DL. Vplyv oxidačného poškodenia DNA v promótorových prvkoch na väzbu transkripčného faktora. Nucleic Acids Res. 1999;27:3213�3218.
104. Marietta C, Gulam H, Brooks PJ. Jediná 8-cyklo-50-deoxyadenozínová lézia v TATA boxe bráni väzbe TATA väzbového proteínu a silne znižuje transkripciu in vivo. Oprava DNA (Amst). 20;2002:1�967.
105. Jackson AL, Chen R, Loeb LA. Vyvolanie nestability mikrosatelitov
oxidačným poškodením DNA. Proc Natl Acad Sci US A. 1998;95:12468�12473.
106. Caldecott KW. Interakcie proteín-proteín počas opravy jednovláknového zlomu cicavčej DNA. Biochem Soc Trans. 2003;31:247�251.
107. Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Oxidačné poškodenie DNA: mechanizmy, mutácie a choroby. FASEB J. 2003;17:1195�1214.
108. Jones PL, Wolffe AP. Vzťahy medzi organizáciou chromatínu a metyláciou DNA pri určovaní génovej expresie. Semin Cancer Biol. 1999;9:339�347.
109. Girotti AW. Mechanizmy peroxidácie lipidov. J Free Radic Biol Med. 1985;1:87�95.
110. Siu GM, Draper HH. Metabolizmus malónaldehydu in vivo a in vitro. Lipidy. 1982;17:349�355.
111. Esterbauer H, Koller E, Slee RG, Koster JF. Možné zapojenie produktu lipidovo-peroxidácie 4-hydroxynonenalu do tvorby fluorescenčných chromolipidov. Biochem J. 1986;239:405-409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. Zmeny hladín peroxidu lipidov v lipoproteínových frakciách ľudského séra závislé od veku. J Gerontol. 1984;39:269�272.
113. Keller JN, Mark RJ, Bruce AJ, Blanc E, Rothstein JD, et al. 4- Hydroxynonenal, aldehydový produkt peroxidácie membránových lipidov, zhoršuje transport glutamátu a mitochondriálnu funkciu v synaptozómoch. Neuroveda. 1997;806:85�96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. Aktivácia stresových signálnych dráh konečným produktom peroxidácie lipidov. 4-hydroxy-2-nonenal je potenciálnym induktorom intracelulárnej produkcie peroxidu. J Biol Chem. 1999;274:2234�2242.
115. Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. Aktivácia receptora EGF oxidovaným LDL. FASEB J. 1998;12:665�671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal zvyšuje produkciu fibronektínu ľudskými pľúcnymi fibroblastami IMR-90 čiastočne prostredníctvom aktivácie extracelulárneho signálu spojeného s receptorom epidermálneho rastového faktora- regulovaná dráha kinázy p44/42. Toxicol Appl Pharmacol. 2002;184:127�135.
117. Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. Vydychovaný 8-izoprostán ako in vivo biomarker pľúcneho oxidačného stresu u pacientov s CHOCHP a zdravých fajčiarov. Am J Respir Crit Care Med. 2000;162:1175�1177.
118. Morrison D, Rahman I, Lannan S, MacNee W. Priepustnosť epitelu, zápal a oxidačný stres vo vzduchových priestoroch fajčiarov. Am J Respir Crit Care Med. 1999;159:473�479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Zvýšený obsah látok reagujúcich s kyselinou tiobarbiturovou a peroxidu vodíka v kondenzáte vydychovaného dychu u pacientov so stabilnou chronickou obštrukčnou chorobou pľúc: žiadny významný vplyv fajčenia cigariet. Respir Med. 1999;93:389�396.
120. Kelly FJ, Mudway IS. Oxidácia bielkovín na rozhraní vzduch-pľúca. Aminokyseliny. 2003;25:375�396.
121. Dean RT, Roberts CR, Jessup W. Fragmentácia extracelulárnych a intracelulárnych polypeptidov voľnými radikálmi. Prog Clin Biol Res. 1985;180:341�350.
122. Keck RG. Použitie t-butylhydroperoxidu ako sondy pre oxidáciu metionínu v proteínoch. Anal Biochem. 1996;236:56-62.
123. Davies KJ. Poškodenie a degradácia bielkovín kyslíkovými radikálmi. I. Všeobecné aspekty. J Biol Chem. 1987;262:9895�9901.
124. Stadtman ER. Oxidácia proteínov katalyzovaná kovovými iónmi: biochemický mechanizmus a biologické dôsledky. Free Radic Biol Med.
1990;9:315�325.
125. Fucci L, Oliver CN, Coon MJ, Stadtman ER. Inaktivácia kľúčových metabolických enzýmov oxidačnými reakciami so zmiešanou funkciou: možný vplyv na premenu bielkovín a starnutie. Proc Natl Acad Sci US A. 1983;80:1521�1525.
126. Stadtman ER, Moskovitz J, Levine RL. Oxidácia metionínových zvyškov bielkovín: biologické dôsledky. Antioxidačný redoxný signál. 2003;5:577�582.
127. Stadtman ER, Levine RL. Voľnými radikálmi sprostredkovaná oxidácia voľných aminokyselín a aminokyselinových zvyškov v proteínoch. Aminokyseliny. 2003;25:207�218.
128. Stadtman ER. Oxidácia bielkovín pri starnutí a chorobách súvisiacich s vekom. Ann NY Acad Sci. 2001;928:22�38.
129. Shacter E. Kvantifikácia a význam oxidácie proteínov v biologických vzorkách. Drug Metab Rev. 2000;32:307�326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidačný stres a bunková signalizácia. Curr Med Chem. 2004;11:1163�1182.
131. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vaskulárny endoteliálny rastový faktor (VEGF) a jeho receptory. FASEB J. 1999;13:9-22.
132. Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS a kol. Regulácia tvorby reaktívnych druhov kyslíka vo fibroblastoch pomocou Rac1. Biochem J. 1996; 318: 379-382.
133. Sun T, Oberley LW. Redoxná regulácia transkripčných aktivátorov. Free Radic Biol Med. 1996;21:335�348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Redoxná regulácia väzby c-Jun DNA reverzibilnou S-glutatioláciou. FASEB J. 1999;13:1481�1490.
135. Reynaert NL, Clesss K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
YM. In situ detekcia S-glutationylovaných proteínov po derivatizácii cysteínu katalyzovanej glutaredoxínom-1. Biochim Biophys Acta. 2006;1760:380�387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulácia glutaredoxínu-1
expresia v myšom modeli alergického ochorenia dýchacích ciest. Am J Respir Cell Mol Biol. 2007;36:147�151.
137. Filomeni G, Rotilio G, Ciriolo MR. Bunková signalizácia a glutatiónový redoxný systém. Biochem Pharmacol. 2002;64:1057�1064.
138. Pande V, Ramos MJ. Molekulárne rozpoznávanie 15-deoxydelta (12,14) prostaglandínu J(2) jadrovým faktorom-kappa B a inými bunkovými proteínmi. Bioorg Med Chem Lett. 2005;15:4057�4063.
139. Perkins ND. Integrácia bunkových signálnych dráh s funkciou NF-kappaB a IKK. Nat Rev Mol Cell Biol. 2007;8:49�62.
140. Gilmore TD. Úvod do NF-kappaB: hráči, cesty, perspektívy. Onkogén. 2006;25:6680�6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Výrazné úlohy tioredoxínu v cytoplazme a v jadre. Dvojstupňový mechanizmus redoxnej regulácie transkripčného faktora NF-kappaB. J Biol Chem. 1999;274:27891�27897.
142. Oddelenie PA. Úloha komplementu, chemokínov a regulačných cytokínov pri akútnom poškodení pľúc. Ann NY Acad Sci. 1996;796:104�112.
143. Akira S, Kishimoto A. NF-IL6 a NF-kB v regulácii cytokínového génu. Adv Immunol. 1997;65:1�46.
144. Meyer M, Schreck R, Baeuerle PA. H2O2 a antioxidanty majú opačné účinky na aktiváciu NF-kappa B a AP-1 v intaktných bunkách: AP-1 ako sekundárny faktor reagujúci na antioxidanty. EMBO J. 1993;12:2005�2015.
145. Abate C, Patel L, Rausher FJ, Curran T. Redoxná regulácia väzbovej aktivity fos a jun DNA in vitro. Veda. 1990;249:1157�1161.
146. Galter D, Mihm S, Droge W. Výrazné účinky glutatióndisulfidu na jadrové transkripčné faktory kB a aktivačný proteín-1. Eur J Biochem. 1994;221:639�648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. Transkripčná aktivita AP-1 je regulovaná priamou asociáciou medzi tioredoxínom a Ref-1. Proc Natl Acad Sci US A. 1997;94: 3633�3638.
Informácie tu uvedené o „El Paso, TX oxidačný stres a antioxidačná obrana" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka