Biochémia bolesti:�Všetky bolestivé syndrómy majú zápalový profil. Zápalový profil sa môže líšiť od osoby k osobe a môže sa líšiť aj u jednej osoby v rôznych časoch. Liečba bolestivých syndrómov spočíva v pochopení tohto zápalového profilu. Bolestivé syndrómy sa liečia medicínsky, chirurgicky alebo oboje. Cieľom je inhibovať/potlačiť produkciu zápalových mediátorov. A úspešný výsledok je ten, ktorý vedie k menšiemu zápalu a samozrejme menšej bolesti.
Obsah
Biochémia bolesti
ciele:
- Kto sú kľúčoví hráči
- Aké sú biochemické mechanizmy?
- Aké sú dôsledky?
Hodnotenie zápalu:
kľúčoví hráči
 Prečo ma bolí rameno? Prehľad neuroanatomického a biochemického základu bolesti ramena
Prečo ma bolí rameno? Prehľad neuroanatomického a biochemického základu bolesti ramena
Abstrakt
Ak sa pacient spýta �prečo ma bolí rameno?� rozhovor sa rýchlo zvrtne na vedeckú teóriu a niekedy nepodložené dohady. Kliník si často uvedomuje limity vedeckého základu ich vysvetlenia, čo poukazuje na neúplnosť nášho chápania povahy bolesti ramena. Tento prehľad využíva systematický prístup, ktorý pomáha odpovedať na základné otázky týkajúce sa bolesti ramena, s cieľom poskytnúť pohľad na budúci výskum a nové metódy liečby bolesti ramena. Preskúmame úlohy (1) periférnych receptorov, (2) periférneho spracovania bolesti alebo „nocicepcie“, (3) miechy, (4) mozgu, (5) umiestnenia receptorov v ramene a (6 ) nervová anatómia ramena. Zvažujeme tiež, ako môžu tieto faktory prispieť k variabilite v klinickom obraze, diagnostike a liečbe bolesti ramena. Týmto spôsobom sa snažíme poskytnúť prehľad komponentov periférneho systému detekcie bolesti a centrálnych mechanizmov spracovania bolesti pri bolestiach ramena, ktoré interagujú a vytvárajú klinickú bolesť.
ÚVOD: VEĽMI STRUČNÁ HISTÓRIA VEDY BOLESTI NEZBYTNÁ PRE KLINIKOV
Povaha bolesti bola vo všeobecnosti v minulom storočí predmetom mnohých kontroverzií. V 17. storočí Descartova teória1 navrhovala, že intenzita bolesti priamo súvisí s množstvom súvisiaceho poranenia tkaniva a že bolesť sa spracováva jednou odlišnou cestou. Mnoho skorších teórií sa opieralo o túto takzvanú „dualistickú“ Descartovskú filozofiu, ktorá videla bolesť ako dôsledok stimulácie „špecifického“ periférneho receptora bolesti v mozgu. V 20. storočí nasledoval vedecký boj medzi dvoma protichodnými teóriami, konkrétne teóriou špecifickosti a teóriou vzorov. Descartovská „teória špecifickosti“ videla bolesť ako špecifickú samostatnú modalitu zmyslového vstupu s vlastným aparátom, zatiaľ čo „teória vzorcov“ sa domnievala, že bolesť je výsledkom intenzívnej stimulácie nešpecifických receptorov.2 V roku 1965 Wall a Melzack 3 teória bolesti poskytla dôkaz pre model, v ktorom bolo vnímanie bolesti modulované ako senzorickou spätnou väzbou, tak aj centrálnym nervovým systémom. Ďalší obrovský pokrok v teórii bolesti približne v rovnakom čase zaznamenal objav špecifického mechanizmu účinku opioidov.4 Následne nedávne pokroky v neurozobrazovaní a molekulárnej medicíne výrazne rozšírili naše celkové chápanie bolesti.
Ako to teda súvisí s bolesťou ramena?�Bolesť ramena je bežným klinickým problémoma dôkladné pochopenie spôsobu, akým telo spracováva bolesť, je nevyhnutné na čo najlepšiu diagnostiku a liečbu pacientovej bolesti. Pokroky v našich znalostiach spracovania bolesti sľubujú vysvetliť nesúlad medzi patológiou a vnímaním bolesti, môžu nám tiež pomôcť vysvetliť, prečo niektorí pacienti nereagujú na určité liečby.
ZÁKLADNÉ STAVEBNÉ BLOKY BOLESTI
Periférne senzorické receptory: mechanoreceptor a „nociceptor“.
V ľudskom muskuloskeletálnom systéme je prítomných množstvo typov periférnych senzorických receptorov. 5 Môžu byť klasifikované na základe ich funkcie (ako mechanoreceptory, termoreceptory alebo nociceptory) alebo morfológie (voľné nervové zakončenia alebo rôzne typy zapuzdrených receptorov).5 Rôzne typy receptorov sa potom môžu ďalej klasifikovať na základe prítomnosť určitých chemických markerov. Napríklad existujú významné prekrytia medzi rôznymi funkčnými triedami receptorov
Spracovanie periférnej bolesti: �Nocicepcia�
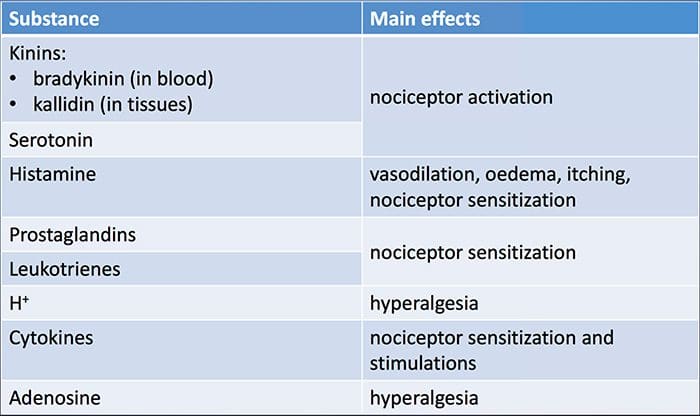
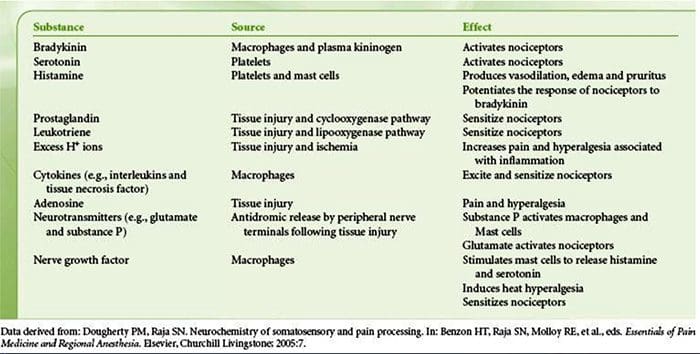
Poškodenie tkaniva zahŕňa rôzne zápalové mediátory uvoľňované poškodenými bunkami vrátane bradykinínu, histamínu, 5-hydroxytryptamínu, ATP, oxidu dusnatého a určitých iónov (K+ a H+). Aktivácia dráhy kyseliny arachidónovej vedie k produkcii prostaglandínov, tromboxánov a leukotriénov. Cytokíny, vrátane interleukínov a tumor nekrotizujúceho faktora ?, a neurotrofíny, ako je nervový rastový faktor (NGF), sa tiež uvoľňujú a sú úzko zapojené do uľahčenia zápalu.15 Ďalšie látky, ako sú excitačné aminokyseliny (glutamát) a opioidy ( endotelín-1) sa tiež podieľajú na akútnej zápalovej odpovedi.16 17 Niektoré z týchto činidiel môžu priamo aktivovať nociceptory, zatiaľ čo iné spôsobujú nábor iných buniek, ktoré potom uvoľňujú ďalšie uľahčujúce činidlá.18 Tento lokálny proces vedie k zvýšenej citlivosti nociceptívnych neurónov na ich normálny vstup a/alebo nábor odpovede na normálne podprahové vstupy sa nazýva „periférna senzibilizácia“.�Obrázok 1 sumarizuje niektoré zo zahrnutých kľúčových mechanizmov.
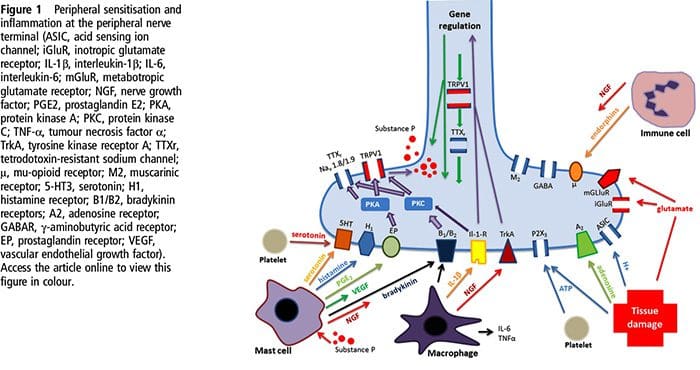 NGF a receptor katiónového kanála s prechodným potenciálom receptora V člen 1 (TRPV1) majú symbiotický vzťah, pokiaľ ide o zápal a senzibilizáciu nociceptora. Cytokíny produkované v zapálenom tkanive vedú k zvýšeniu produkcie NGF.19 NGF stimuluje uvoľňovanie histamínu a serotonínu (5-HT3) žírnymi bunkami a tiež senzibilizuje nociceptory, čo môže zmeniť vlastnosti A? vlákna tak, že väčšia časť sa stáva nociceptívnou. Receptor TRPV1 je prítomný v subpopulácii primárnych aferentných vlákien a je aktivovaný kapsaicínom, teplom a protónmi. Receptor TRPV1 je syntetizovaný v bunkovom tele aferentného vlákna a je transportovaný do periférnych aj centrálnych zakončení, kde prispieva k senzitivite nociceptívnych aferentov. Zápal vedie k periférnej produkcii NGF, ktorý sa potom naviaže na receptor tyrozínkinázy typu 1 na zakončeniach nociceptora, NGF je potom transportovaný do bunkového tela, kde vedie k upregulácii transkripcie TRPV1 a následne k zvýšeniu citlivosti nociceptora.19 20 NGF a iné zápalové mediátory tiež senzibilizujú TRPV1 prostredníctvom rôznorodého radu sekundárnych mediátorových dráh. Mnoho ďalších receptorov vrátane cholinergných receptorov, receptorov kyseliny a-aminomaslovej (GABA) a somatostatínových receptorov sa tiež považuje za zapojené do periférnej citlivosti nociceptorov.
NGF a receptor katiónového kanála s prechodným potenciálom receptora V člen 1 (TRPV1) majú symbiotický vzťah, pokiaľ ide o zápal a senzibilizáciu nociceptora. Cytokíny produkované v zapálenom tkanive vedú k zvýšeniu produkcie NGF.19 NGF stimuluje uvoľňovanie histamínu a serotonínu (5-HT3) žírnymi bunkami a tiež senzibilizuje nociceptory, čo môže zmeniť vlastnosti A? vlákna tak, že väčšia časť sa stáva nociceptívnou. Receptor TRPV1 je prítomný v subpopulácii primárnych aferentných vlákien a je aktivovaný kapsaicínom, teplom a protónmi. Receptor TRPV1 je syntetizovaný v bunkovom tele aferentného vlákna a je transportovaný do periférnych aj centrálnych zakončení, kde prispieva k senzitivite nociceptívnych aferentov. Zápal vedie k periférnej produkcii NGF, ktorý sa potom naviaže na receptor tyrozínkinázy typu 1 na zakončeniach nociceptora, NGF je potom transportovaný do bunkového tela, kde vedie k upregulácii transkripcie TRPV1 a následne k zvýšeniu citlivosti nociceptora.19 20 NGF a iné zápalové mediátory tiež senzibilizujú TRPV1 prostredníctvom rôznorodého radu sekundárnych mediátorových dráh. Mnoho ďalších receptorov vrátane cholinergných receptorov, receptorov kyseliny a-aminomaslovej (GABA) a somatostatínových receptorov sa tiež považuje za zapojené do periférnej citlivosti nociceptorov.
Veľký počet zápalových mediátorov sa špecificky podieľa na bolestiach ramena a ochorení rotátorovej manžety.21�25 Zatiaľ čo niektoré chemické mediátory priamo aktivujú nociceptory, väčšina vedie skôr k zmenám v samotnom senzorickom neuróne, než by ho priamo aktivovala. Tieto zmeny môžu byť závislé od skorej post-translačnej alebo oneskorenej transkripcie. Príkladmi prvých sú zmeny v receptore TRPV1 alebo v napäťovo riadených iónových kanáloch, ktoré sú výsledkom fosforylácie membránovo viazaných proteínov. Príklady posledne menovaných zahŕňajú zvýšenie produkcie kanálov TRV1 indukované NGF a aktiváciu intracelulárnych transkripčných faktorov indukovanú vápnikom.
Molekulárne mechanizmy nocicepcie
Pocit bolesti nás upozorňuje na skutočné alebo hroziace zranenie a spúšťa vhodné ochranné reakcie. Bohužiaľ, bolesť často prežije svoju užitočnosť ako varovný systém a namiesto toho sa stáva chronickou a oslabujúcou. Tento prechod do chronickej fázy zahŕňa zmeny v mieche a mozgu, ale existuje aj pozoruhodná modulácia, kde sa iniciujú správy o bolesti – na úrovni primárneho senzorického neurónu. Úsilie určiť, ako tieto neuróny detegujú podnety spôsobujúce bolesť tepelnej, mechanickej alebo chemickej povahy, odhalili nové signalizačné mechanizmy a priviedli nás bližšie k pochopeniu molekulárnych dejov, ktoré uľahčujú prechody od akútnej k pretrvávajúcej bolesti.
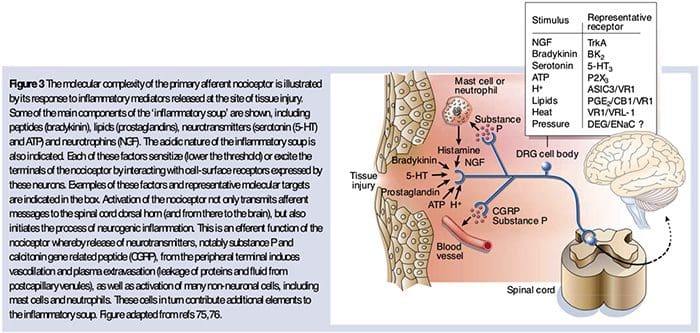 Neurochémia nociceptorov
Neurochémia nociceptorov
Glutamát je prevládajúci excitačný neurotransmiter vo všetkých nociceptoroch. Histochemické štúdie dospelých DRG však odhaľujú dve široké triedy nemyelinizovaných vlákien C.
Chemické prevodníky na zhoršenie bolesti
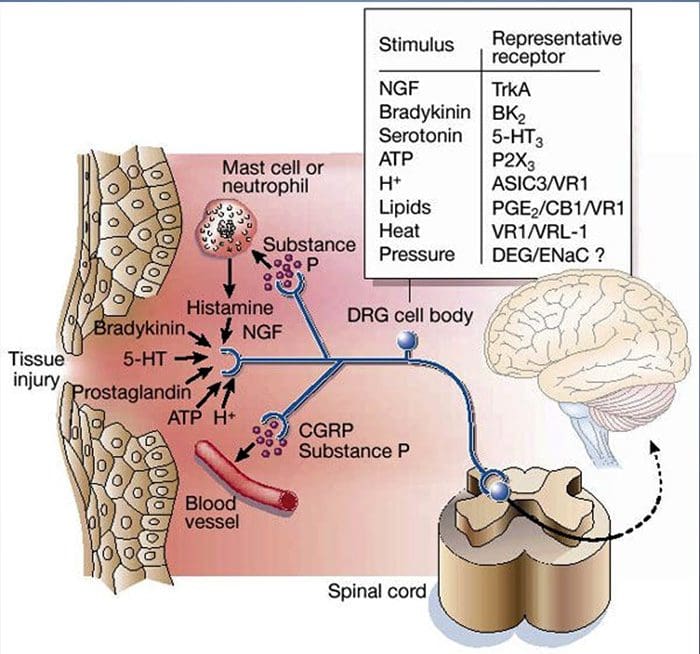
Ako je opísané vyššie, zranenie zvyšuje našu bolesť tým, že zvyšuje citlivosť nociceptorov na tepelné aj mechanické stimuly. Tento jav je čiastočne výsledkom produkcie a uvoľňovania chemických mediátorov z primárneho senzorického zakončenia az neneurálnych buniek (napríklad fibroblastov, žírnych buniek, neutrofilov a krvných doštičiek) v prostredí36 (obr. 3). Niektoré zložky zápalovej polievky (napríklad protóny, ATP, serotonín alebo lipidy) môžu meniť neurónovú excitabilitu priamo interakciou s iónovými kanálmi na povrchu nociceptora, zatiaľ čo iné (napríklad bradykinín a NGF) sa viažu na metabotropné receptory a sprostredkúvajú svoje účinky prostredníctvom signálnych kaskád druhého posla11. V pochopení biochemického základu takýchto modulačných mechanizmov sa dosiahol značný pokrok.
Extracelulárne protóny a acidóza tkanív
Lokálna acidóza tkaniva je charakteristickou fyziologickou odpoveďou na poranenie a stupeň súvisiacej bolesti alebo nepohodlia dobre koreluje s veľkosťou acidifikácie37. Aplikácia kyseliny (pH 5) na kožu vytvára trvalé výboje v tretine alebo viacerých polymodálnych nociceptoroch, ktoré inervujú receptívne pole 20.
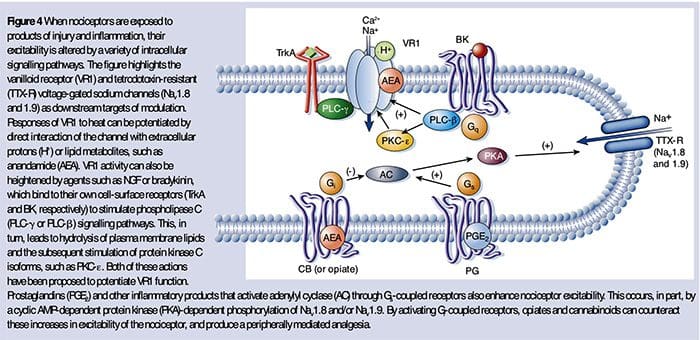 Bunkové a molekulárne mechanizmy bolesti
Bunkové a molekulárne mechanizmy bolesti
abstraktné
Nervový systém detekuje a interpretuje širokú škálu tepelných a mechanických stimulov, ako aj environmentálnych a endogénnych chemických dráždidiel. Keď sú tieto stimuly intenzívne, generujú akútnu bolesť a pri pretrvávajúcom poškodení vykazujú zložky periférneho aj centrálneho nervového systému dráhy prenosu bolesti obrovskú plasticitu, zosilňujú signály bolesti a spôsobujú precitlivenosť. Keď plasticita uľahčuje ochranné reflexy, môže to byť prospešné, ale keď zmeny pretrvávajú, môže to viesť k chronickej bolesti. Genetické, elektrofyziologické a farmakologické štúdie objasňujú molekulárne mechanizmy, ktoré sú základom detekcie, kódovania a modulácie škodlivých stimulov, ktoré spôsobujú bolesť.
Úvod: Akútna verzus pretrvávajúca bolesť
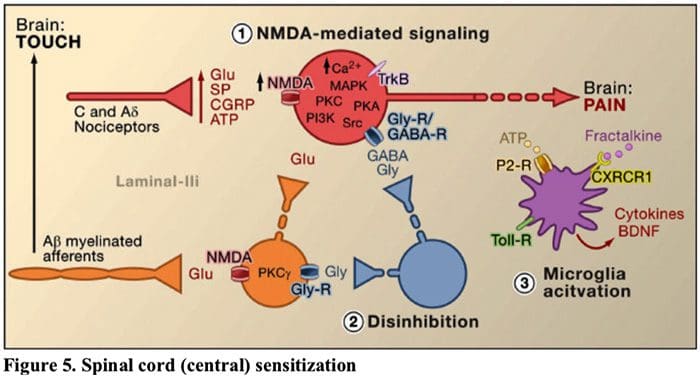 Obrázok 5. Miechová (centrálna) senzibilizácia
Obrázok 5. Miechová (centrálna) senzibilizácia
- Glutamát/NMDA receptorom sprostredkovaná senzibilizácia.�Po intenzívnej stimulácii alebo pretrvávajúcom poranení sa aktivovali C a A? nociceptory uvoľňujú rôzne neurotransmitery vrátane dlutamátu, substancie P, peptidu súvisiaceho s génom kalcitonínu (CGRP) a ATP na výstupné neuróny v lamine I povrchového dorzálneho rohu (červená). V dôsledku toho môžu normálne tiché glutamátové receptory NMDA umiestnené v postsynaptickom neuróne teraz signalizovať, zvyšovať intracelulárny vápnik a aktivovať množstvo signálnych dráh závislých od vápnika a druhých poslov vrátane mitogénom aktivovanej proteínkinázy (MAPK), proteínkinázy C (PKC) proteínkináza A (PKA) a Src. Táto kaskáda udalostí zvýši excitabilitu výstupného neurónu a uľahčí prenos správ o bolesti do mozgu.
- Dezinhibícia.�Za normálnych okolností inhibičné interneuróny (modré) nepretržite uvoľňujú GABA a/alebo glycín (Gly), aby sa znížila excitabilita výstupných neurónov laminy I a modulovali sa prenos bolesti (inhibičný tón). V prípade poranenia sa však táto inhibícia môže stratiť, čo vedie k hyperalgézii. Okrem toho môže dezinhibícia umožniť nenociceptívny myelinizovaný Ap. primárne aferenty na zapojenie obvodu prenosu bolesti tak, že normálne neškodné stimuly sú teraz vnímané ako bolestivé. K tomu dochádza čiastočne prostredníctvom dezinhibície excitačnej PKC? exprimujúce interneuróny vo vnútornej vrstve II.
- Aktivácia mikroglií.�Poranenie periférnych nervov podporuje uvoľňovanie ATP a chemokínu fraktalkínu, ktorý stimuluje mikrogliálne bunky. Najmä aktivácia purinergných, CX3CR1 a Toll-like receptorov na mikrogliách (fialová) má za následok uvoľnenie neurotrofického faktora odvodeného z mozgu (BDNF), ktorý prostredníctvom aktivácie TrkB receptorov exprimovaných výstupnými neurónmi lamina I podporuje zvýšenú excitabilitu a zvýšená bolesť v reakcii na škodlivú aj neškodnú stimuláciu (to znamená hyperalgézia a alodýnia). Aktivované mikroglie tiež uvoľňujú množstvo cytokínov, ako je tumor nekrotizujúci faktor ? (TNFa), interleukín-1? a 6 (IL-1p, IL-6) a ďalšie faktory, ktoré prispievajú k centrálnej senzibilizácii.
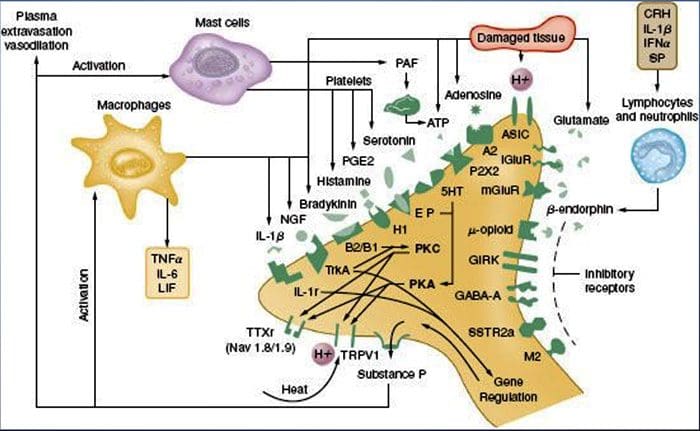
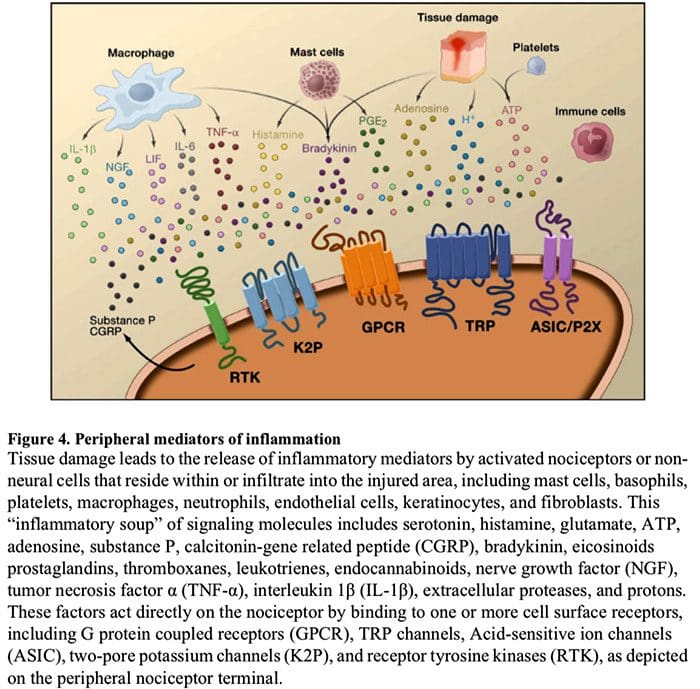
Chemické prostredie zápalu
Periférna senzibilizácia je častejšie výsledkom zmien spojených so zápalom v chemickom prostredí nervového vlákna (McMahon et al., 2008). Poškodenie tkaniva je teda často sprevádzané akumuláciou endogénnych faktorov uvoľnených z aktivovaných nociceptorov alebo neneurálnych buniek, ktoré sa nachádzajú v poranenej oblasti alebo do nej infiltrujú (vrátane žírnych buniek, bazofilov, krvných doštičiek, makrofágov, neutrofilov, endotelových buniek, keratinocytov a fibroblasty). kolektívne. tieto faktory, označované ako „zápalová polievka“, predstavujú širokú škálu signálnych molekúl, vrátane neurotransmiterov, peptidov (látka P, CGRP, bradykinín), eikozinoidov a príbuzných lipidov (prostaglandíny, tromboxány, leukotriény, endokanabinoidy), neurotrofínov, cytokínov a chemokíny, ako aj extracelulárne proteázy a protóny. Je pozoruhodné, že nociceptory exprimujú jeden alebo viac bunkových povrchových receptorov schopných rozpoznať a reagovať na každé z týchto prozápalových alebo proalgetických činidiel (obrázok 4). Takéto interakcie zvyšujú excitabilitu nervového vlákna, čím zvyšujú jeho citlivosť na teplotu alebo dotyk.
Nepochybne najbežnejší prístup k zníženiu zápalovej bolesti zahŕňa inhibíciu syntézy alebo akumulácie zložiek zápalovej polievky. Najlepším príkladom toho sú nesteroidné protizápalové lieky, ako je aspirín alebo ibuprofén, ktoré znižujú zápalovú bolesť a hyperalgéziu inhibíciou cyklooxygenáz (Cox-1 a Cox-2), ktoré sa podieľajú na syntéze prostaglandínov. Druhým prístupom je blokovanie pôsobenia zápalových činidiel na nociceptore. Tu zdôrazňujeme príklady, ktoré poskytujú nový pohľad na bunkové mechanizmy periférnej senzibilizácie alebo ktoré tvoria základ nových terapeutických stratégií na liečbu zápalovej bolesti.
NGF je možno najlepšie známy pre svoju úlohu neurotrofického faktora potrebného na prežitie a vývoj senzorických neurónov počas embryogenézy, ale u dospelých sa NGF produkuje aj pri poškodení tkaniva a tvorí dôležitú zložku zápalovej polievky (Ritner et al., 2009). Spomedzi svojich mnohých bunkových cieľov pôsobí NGF priamo na nociceptory peptidergických vlákien C, ktoré exprimujú vysoko afinitnú receptorovú tyrozínkinázu NGF, TrkA, ako aj nízkoafinitný neurotrofínový receptor p75 (Chao, 2003; Snider a McMahon, 1998). NGF spôsobuje hlbokú precitlivenosť na teplo a mechanické stimuly prostredníctvom dvoch časovo odlišných mechanizmov. Najprv interakcia NGF-TrkA aktivuje downstream signálne dráhy, vrátane fosfolipázy C (PLC), mitogénom aktivovanej proteínkinázy (MAPK) a fosfoinozitid-3-kinázy (PI3K). To vedie k funkčnej potenciácii cieľových proteínov na periférnom konci nociceptoru, najmä TRPV1, čo vedie k rýchlej zmene bunkovej a behaviorálnej citlivosti na teplo (Chuang et al., 2001).
Bez ohľadu na ich pro-nociceptívne mechanizmy sa interferencia s neurotrofínovou alebo cytokínovou signalizáciou stala hlavnou stratégiou kontroly zápalového ochorenia alebo výslednej bolesti. Hlavný prístup zahŕňa blokovanie NGF alebo TNF-? pôsobenie neutralizačnej protilátky. V prípade TNF-a to bolo pozoruhodne účinné pri liečbe mnohých autoimunitných ochorení, vrátane reumatoidnej artritídy, čo viedlo k dramatickému zníženiu deštrukcie tkaniva a sprievodnej hyperalgézie (Atzeni et al., 2005). Pretože hlavné účinky NGF na dospelý nociceptor sa vyskytujú na pozadí zápalu, výhodou tohto prístupu je, že hyperalgézia sa zníži bez ovplyvnenia normálne vnímanie bolesti. Anti-NGF protilátky sú v súčasnosti skutočne v klinických skúškach na liečbu syndrómov zápalovej bolesti (Hefti et al., 2006).
Glutamát/NMDA receptorom sprostredkovaná senzibilizácia
Akútna bolesť je signalizovaná uvoľňovaním glutamátu z centrálnych zakončení nociceptorov, čím sa vytvárajú excitačné postsynaptické prúdy (EPSC) v neurónoch dorzálnych rohov druhého poriadku. K tomu dochádza predovšetkým prostredníctvom aktivácie postsynaptických AMPA a kainátových podtypov ionotropných glutamátových receptorov. Sumácia podprahových EPSC v postsynaptickom neuróne nakoniec povedie k spusteniu akčného potenciálu a prenosu správy o bolesti na neuróny vyššieho rádu.
Iné štúdie naznačujú, že zmeny v samotnom projekčnom neuróne prispievajú k inhibičnému procesu. Napríklad poškodenie periférnych nervov výrazne znižuje K+- Cl- kotransportér KCC2, ktorý je nevyhnutný na udržanie normálnych gradientov K+ a Cl- cez plazmatickú membránu (Coull et al., 2003). Downregulácia KCC2, ktorý je exprimovaný v projekčných neurónoch lamina I, vedie k posunu v gradiente Cl, takže aktivácia receptorov GABA-A depolarizuje, a nie hyperpolarizuje projekčné neuróny lamina I. To by zase zvýšilo excitabilitu a zvýšilo prenos bolesti. Farmakologická blokáda alebo downregulácia KCC2 sprostredkovaná siRNA u potkanov skutočne indukuje mechanickú alodýniu.
Zdroje:
Prečo ma bolí rameno? Prehľad neuroanatomického a biochemického základu bolesti ramena
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Bunkové a molekulárne mechanizmy bolesti
Allan I. Basbaum1, Diana M. Bautista2, Gre?gory Scherrer1 a David Julius3
1Katedra anatómie, Kalifornská univerzita, San Francisco 94158
2Katedra molekulárnej a bunkovej biológie, Kalifornská univerzita, Berkeley CA 94720 3Katedra fyziológie, Kalifornská univerzita, San Francisco 94158
Molekulárne mechanizmy nocicepcie
David Julius* a Allan I. Basbaum�
*Katedra bunkovej a molekulárnej farmakológie a �Katedry anatómie a fyziológie a WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, USA (e-mail: julius@socrates.ucsf.edu)
Informácie tu uvedené o „Biochémia bolesti" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka







