Neurogénny zápal, alebo NI, je fyziologický proces, pri ktorom sa mediátory uvoľňujú priamo z kožných nervov, aby sa začala zápalová odpoveď. To vedie k vytvoreniu lokálnych zápalových reakcií vrátane erytému, opuchu, zvýšenia teploty, citlivosti a bolesti. Za uvoľňovanie týchto zápalových mediátorov sú do značnej miery zodpovedné jemné nemyelinizované aferentné somatické C-vlákna, ktoré reagujú na nízku intenzitu mechanickej a chemickej stimulácie.
Keď sú tieto nervové dráhy v kožných nervoch stimulované, uvoľňujú energetické neuropeptidy alebo látku P a peptid súvisiaci s génom kalcitonínu (CGRP) rýchlo do mikroprostredia, čím spúšťajú sériu zápalových reakcií. Existuje významný rozdiel v imunogénnom zápale, čo je úplne prvá ochranná a reparačná reakcia imunitného systému, keď patogén vstúpi do tela, zatiaľ čo neurogénny zápal zahŕňa priame spojenie medzi nervovým systémom a zápalovými reakciami. Aj keď neurogénny zápal a imunologický zápal môžu existovať súčasne, nie sú tieto dva klinicky rozlíšiteľné. Účelom nižšie uvedeného článku je diskutovať o mechanizme neurogénneho zápalu a úlohe periférneho nervového systému v obrane hostiteľa a imunopatológii.
Obsah
Neurogénny zápal – Úloha periférneho nervového systému v obrane hostiteľa a v imunopatológii
abstraktné
Periférny nervový a imunitný systém sa tradične považuje za systém slúžiaci oddeleným funkciám. Táto línia je však čoraz viac rozmazaná novými pohľadmi na neurogénny zápal. Nociceptorové neuróny majú mnoho rovnakých molekulárnych ciest rozpoznávania nebezpečenstva ako imunitné bunky a v reakcii na nebezpečenstvo komunikuje periférny nervový systém priamo s imunitným systémom a vytvára integrovaný ochranný mechanizmus. Hustá inervačná sieť senzorických a autonómnych vlákien v periférnych tkanivách a vysoká rýchlosť nervovej transdukcie umožňuje rýchlu lokálnu a systémovú neurogénnu moduláciu imunity. Zdá sa, že periférne neuróny zohrávajú významnú úlohu aj pri imunitnej dysfunkcii pri autoimunitných a alergických ochoreniach. Preto pochopenie koordinovanej interakcie periférnych neurónov s imunitnými bunkami môže pokročiť v terapeutických prístupoch na zvýšenie obrany hostiteľa a potlačenie imunopatológie.
úvod
Pred dvetisíc rokmi Celsus definoval zápal ako zápal zahŕňajúci štyri hlavné znaky: Dolor (bolesť), Calor (teplo), Rubor (začervenanie) a Tumor (opuch), čo je pozorovanie naznačujúce, že aktivácia nervového systému bola uznaná ako neoddeliteľná súčasť zápal. Na bolesť sa však odvtedy myslelo hlavne ako na symptóm, a nie na účastníka vytvárania zápalu. V tejto perspektíve ukazujeme, že periférny nervový systém zohráva priamu a aktívnu úlohu pri modulácii vrodených a adaptívnych imunity, takže imunitné a nervové systémy môžu mať spoločnú integrovanú ochrannú funkciu v hostiteľskej obrane a reakcii na poškodenie tkaniva, zložitého interakcie, ktorá môže tiež viesť k patológii alergických a autoimunitných ochorení.
Prežitie organizmov kriticky závisí od schopnosti postaviť sa na obranu proti potenciálnemu poškodeniu spôsobenému poškodením tkaniva a infekciou. Obrana hostiteľa zahŕňa vyhýbavé správanie na odstránenie kontaktu s nebezpečným (škodlivým) prostredím (neurálna funkcia) a aktívnu neutralizáciu patogénov (imunitná funkcia). Tradične sa úloha imunitného systému v boji proti infekčným agens a pri oprave poranenia tkaniva považovala za celkom odlišnú od úlohy nervového systému, ktorý premieňa škodlivé environmentálne a vnútorné signály na elektrickú aktivitu, ktorá vytvára pocity a reflexy (obr. 1). Navrhujeme, aby tieto dva systémy boli vlastne súčasťami jednotného obranného mechanizmu. Somatosenzorický nervový systém je ideálne umiestnený na detekciu nebezpečenstva. Po prvé, všetky tkanivá, ktoré sú vysoko exponované vonkajšiemu prostrediu, ako sú epiteliálne povrchy kože, pľúc, močového a tráviaceho traktu, sú husto inervované nociceptormi, zmyslovými vláknami produkujúcimi vysoký prah bolesti. Po druhé, prenos škodlivých vonkajších stimulov je takmer okamžitý, rádovo rýchlejší ako mobilizácia vrodeného imunitného systému, a preto môže byť „prvou odozvou“ pri obrane hostiteľa.
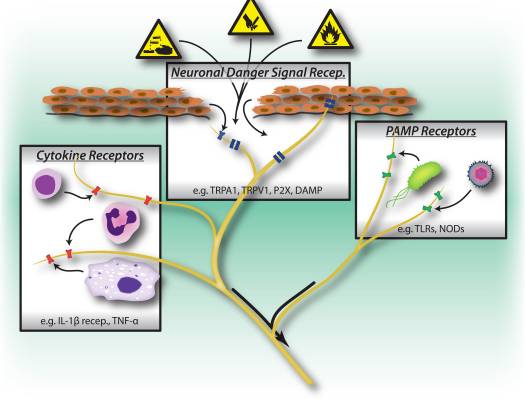
Obrázok 1: Škodlivé podnety, mikrobiálne a zápalové rozpoznávacie dráhy spúšťajú aktiváciu periférneho nervového systému. Senzorické neuróny majú niekoľko prostriedkov na zisťovanie prítomnosti škodlivých/škodlivých stimulov. 1) Nebezpečné signálne receptory vrátane TRP kanálov, P2X kanálov a receptory molekulového vzoru spojeného s nebezpečenstvom (DAMP) rozpoznávajú exogénne signály z prostredia (napr. teplo, kyslosť, chemikálie) alebo endogénne signály nebezpečenstva uvoľnené počas traumy/poškodenia tkaniva (napr. ATP, kyselina močová, hydroxynonaly). 2) Receptory na rozpoznávanie vzorov (PRR), ako sú Toll-like receptory (TLR) a Nod-like receptory (NLR), rozpoznávajú patogénne molekulové vzory (PAMP), ktoré sa vylučujú inváziou baktérií alebo vírusov počas infekcie. 3) Cytokínové receptory rozpoznávajú faktory vylučované imunitnými bunkami (napr. IL-1beta, TNF-alfa, NGF), ktoré aktivujú mapové kinázy a iné signalizačné mechanizmy na zvýšenie excitability membrány.
Okrem ortodromických vstupov do miechy a mozgu z periférie sa akčné potenciály v nociceptorových neurónoch môžu prenášať aj antidromicky v bodoch vetvenia späť na perifériu, axónový reflex. Tieto spolu s trvalými lokálnymi depolarizáciami vedú k rýchlemu a lokálnemu uvoľneniu nervových mediátorov z periférnych axónov aj terminálov (obr. 2). indukuje vazodilatáciu kože, čo viedlo ku konceptu „neurogénneho zápalu“ nezávislého od zápalu produkovaného imunitným systémom (obr. 1).
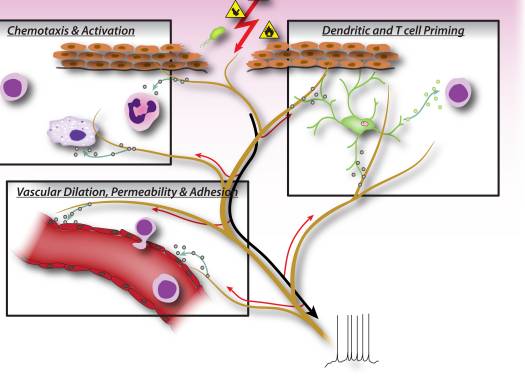
Obrázok 2: Neurónové faktory uvoľňované z nociceptorových senzorických neurónov priamo riadia chemotaxiu leukocytov, vaskulárnu hemodynamiku a imunitnú odpoveď. Keď škodlivé stimuly aktivujú aferentné signály v senzorických nervoch, vytvárajú sa antidromické axónové reflexy, ktoré indukujú uvoľňovanie neuropeptidov na periférnych zakončeniach neurónov. Tieto molekulárne mediátory majú niekoľko zápalových účinkov: 1) Chemotaxia a aktivácia neutrofilov, makrofágov a lymfocytov v mieste poškodenia a degranulácia žírnych buniek. 2) Signalizácia vaskulárnym endotelovým bunkám na zvýšenie prietoku krvi, vaskulárne presakovanie a edém. To tiež umožňuje ľahší nábor zápalových leukocytov. 3) Priming dendritických buniek na riadenie následnej diferenciácie pomocných T buniek na podtypy Th2 alebo Th17.

Obrázok 3: Časová os pokrokov v chápaní neurogénnych aspektov zápalu od Celsa po súčasnosť.
Neurogénny zápal je sprostredkovaný uvoľňovaním neuropeptidov, peptidu súvisiaceho s génom kalcitonínu (CGRP) a substancie P (SP) z nociceptorov, ktoré pôsobia priamo na vaskulárne endotelové bunky a bunky hladkého svalstva 2�5. CGRP vyvoláva vazodilatačné účinky 2, 3, zatiaľ čo SP zvyšuje kapilárnu permeabilitu, čo vedie k extravazácii plazmy a edému 4, 5, čo prispieva k ruboru, kalorácii a nádoru Celsus. Nociceptory však uvoľňujú mnoho ďalších neuropeptidov (online databáza: www.neuropeptides.nl/), vrátane adrenomedulínu, neurokinínov A a B, vazoaktívneho črevného peptidu (VIP), neuropeptidu (NPY) a peptidu uvoľňujúceho gastrín (GRP), ako aj iných molekulárnych mediátorov, ako je glutamát, oxid dusnatý (NO) a cytokíny, ako je eotaxín 6.
Teraz si uvedomujeme, že mediátory uvoľnené zo senzorických neurónov na periférii pôsobia nielen na vaskulatúru, ale tiež priamo priťahujú a aktivujú vrodené imunitné bunky (žírne bunky, dendritické bunky) a adaptívne imunitné bunky (T lymfocyty) 7�12. Pri akútnom poškodení tkaniva sa domnievame, že neurogénny zápal je ochranný, uľahčuje fyziologické hojenie rán a imunitnú obranu proti patogénom aktiváciou a náborom imunitných buniek. Takáto neuroimunitná komunikácia však pravdepodobne tiež hrá hlavnú úlohu v patofyziológii alergických a autoimunitných ochorení zosilnením patologických alebo maladaptívnych imunitných reakcií. Napríklad na zvieracích modeloch reumatoidnej artritídy Levine a kolegovia ukázali, že denervácia kĺbu vedie k výraznému oslabeniu zápalu, ktorý je závislý od nervovej expresie substancie P 13, 14. V nedávnych štúdiách alergických zápalov dýchacích ciest, kolitídy a psoriáza, primárne senzorické neuróny hrajú ústrednú úlohu pri iniciovaní a zvyšovaní aktivácie vrodenej a adaptívnej imunity 15�17.
Navrhujeme preto, aby periférny nervový systém zohrával nielen pasívnu úlohu pri obrane hostiteľa (detekcia škodlivých stimulov a iniciovanie vyhýbavého správania), ale aj aktívnu úlohu v zhode s imunitným systémom pri modulácii odpovedí na škodlivé látky a boji proti nim. stimuly, úlohu, ktorá môže byť narušená, aby prispela k chorobe.
Spoločné cesty rozpoznávania nebezpečenstva v periférnych nervových a vrodených imunitných systémoch
Periférne senzorické neuróny sú prispôsobené na rozpoznávanie nebezpečenstva pre organizmus na základe ich citlivosti na intenzívne mechanické, tepelné a dráždivé chemické podnety (obr. 1). Iónové kanály s prechodným receptorovým potenciálom (TRP) sú najviac študovanými molekulárnymi mediátormi nocicepcie, ktoré vedú neselektívny vstup katiónov po aktivácii rôznymi škodlivými stimulmi. TRPV1 je aktivovaný vysokými teplotami, nízkym pH a kapsaicínom, vallinoidnou dráždivou zložkou chilli papričiek 18. TRPA1 sprostredkováva detekciu reaktívnych chemikálií vrátane environmentálnych dráždivých látok, ako je slzný plyn a priemyselné izotiokyanáty 19, ale čo je dôležitejšie, aktivuje sa aj počas tkaniva poranenie endogénnymi molekulárnymi signálmi vrátane 4-hydroxynonenalu a prostaglandínov 20, 21.
Je zaujímavé, že senzorické neuróny zdieľajú mnohé z rovnakých patogénnych a nebezpečných molekulárnych receptorových dráh ako bunky vrodenej imunity, čo im umožňuje tiež detekovať patogény (obr. 1). V imunitnom systéme sú mikrobiálne patogény detegované zárodočnými kódovanými receptormi na rozpoznávanie vzorov (PRR), ktoré rozpoznávajú široko konzervované molekulárne vzory spojené s exogénnym patogénom (PAMP). Prvé PRR, ktoré boli identifikované, boli členovia rodiny toll-like receptorov (TLR), ktoré sa viažu na kvasinky, komponenty bunkovej steny odvodené od baktérií a vírusovú RNA 22. Po aktivácii PRR sa aktivujú downstream signálne dráhy, ktoré indukujú produkciu a aktiváciu cytokínov adaptívnej imunity. Okrem TLR sú vrodené imunitné bunky aktivované počas poškodenia tkaniva endogénnymi signálmi nebezpečenstva, ktoré sú tiež známe ako molekulárne vzorce spojené s poškodením (DAMP) alebo alarmíny 23, 24. Tieto nebezpečné signály zahŕňajú HMGB1, kyselinu močovú a uvoľnené proteíny tepelného šoku. odumieraním buniek počas nekrózy, aktiváciou imunitných buniek počas neinfekčných zápalových reakcií.
PRR vrátane TLR 3, 4, 7 a 9 sú exprimované nociceptorovými neurónmi a stimulácia TLR ligandmi vedie k indukcii vnútorných prúdov a senzibilizácii nociceptorov na iné bolestivé stimuly 25�27. Okrem toho, aktivácia senzorických neurónov ligandom TLR7 imikvimodom vedie k aktivácii senzorickej dráhy špecifickej pre svrbenie 25. Tieto výsledky naznačujú, že bolesť a svrbenie spojené s infekciou môžu byť čiastočne spôsobené priamou aktiváciou neurónov faktormi odvodenými od patogénu, ktoré zase aktivovať imunitné bunky periférnym uvoľňovaním neurónových signálnych molekúl.
Hlavným DAMP/alarmínom uvoľneným počas bunkového poškodenia je ATP, ktorý je rozpoznávaný purinergnými receptormi tak na nociceptorových neurónoch, ako aj na imunitných bunkách 28�30. Purinergné receptory sa skladajú z dvoch rodín: receptory P2X, katiónové kanály riadené ligandom, a receptory P2Y, receptory spojené s G-proteínom. V nociceptorových neurónoch dochádza k rozpoznávaniu ATP prostredníctvom P2X3, čo vedie k rýchlej denzitizácii katiónových prúdov a bolesti 28, 30 (obr. 1), zatiaľ čo receptory P2Y prispievajú k aktivácii nociceptora senzibilizáciou TRP a napäťovo riadených sodíkových kanálov. V makrofágoch vedie väzba ATP k receptorom P2X7 k hyperpolarizácii a následnej aktivácii zápalu, molekulárneho komplexu dôležitého pri vytváraní IL-1beta a IL-18 29. Preto je ATP silným nebezpečným signálom, ktorý aktivuje periférne neuróny aj vrodené imunitu počas poranenia a niektoré dôkazy dokonca naznačujú, že neuróny exprimujú časti zápalového molekulárneho aparátu 31.
Odvrátenou stranou nebezpečných signálov v nociceptoroch je úloha TRP kanálov pri aktivácii imunitných buniek. TRPV2, homológ TRPV1 aktivovaný škodlivým teplom, je exprimovaný vo vysokých hladinách v bunkách vrodenej imunity. 32. Genetická ablácia TRPV2 viedla k defektom vo fagocytóze makrofágov a odstráneniu bakteriálnych infekcií. ich degranulácia 32. Zostáva určiť, či endogénne signály nebezpečenstva aktivujú imunitné bunky podobným spôsobom ako nociceptory.
Kľúčovým prostriedkom komunikácie medzi imunitnými bunkami a nociceptorovými neurónmi sú cytokíny. Po aktivácii cytokínových receptorov sa v senzorických neurónoch aktivujú dráhy prenosu signálu, čo vedie k downstream fosforylácii membránových proteínov vrátane TRP a napäťovo riadených kanálov (obr. 1). Výsledná senzibilizácia nociceptorov znamená, že normálne neškodné mechanické a tepelné stimuly môžu teraz nociceptory aktivovať. Interleukín 1 beta a TNF-alfa sú dva dôležité cytokíny uvoľňované bunkami vrodenej imunity počas zápalu. IL-1beta a TNF-alfa sú priamo snímané nociceptormi, ktoré exprimujú príbuzné receptory, indukujú aktiváciu mapových kináz p38, čo vedie k zvýšenej excitabilite membrány 34�36. Nervový rastový faktor (NGF) a prostaglandín E(2) sú tiež hlavné zápalové mediátory uvoľňované z imunitných buniek, ktoré pôsobia priamo na periférne senzorické neuróny a spôsobujú senzibilizáciu. Dôležitým účinkom senzibilizácie nociceptora imunitnými faktormi je zvýšené uvoľňovanie neuropeptidov na periférnych zakončeniach, ktoré ďalej aktivujú imunitné bunky, čím sa indukuje pozitívna spätná väzba, ktorá riadi a uľahčuje zápal.
Kontrola vrodenej a adaptívnej imunity senzorickým nervovým systémom
V skorých fázach zápalu senzorické neuróny signalizujú žírnym bunkám a dendritickým bunkám, ktoré sú rezidentnými v tkanive, čo sú vrodené imunitné bunky dôležité pri spúšťaní imunitnej odpovede (obr. 2). Anatomické štúdie ukázali priamu apozíciu terminálov so žírnymi bunkami, ako aj s dendritickými bunkami a neuropeptidy uvoľnené z nociceptorov môžu indukovať degranuláciu alebo produkciu cytokínov v týchto bunkách 7, 9, 37. Táto interakcia hrá dôležitú úlohu pri alergických dýchacích cestách zápal a dermatitída 10�12.
Počas efektorovej fázy zápalu si imunitné bunky musia nájsť cestu k špecifickému miestu poranenia. Mnohé mediátory uvoľňované zo senzorických neurónov, neuropeptidy, chemokíny a glutamát, sú chemotaktické pre neutrofily, eozinofily, makrofágy a T-bunky a zvyšujú endoteliálnu adhéziu, ktorá uľahčuje navádzanie imunitných buniek 6, 38�41 (obr. 2). Okrem toho niektoré dôkazy naznačujú, že neuróny sa môžu priamo podieľať na efektorovej fáze, pretože samotné neuropeptidy môžu mať priame antimikrobiálne funkcie 42.
Neurónovo odvodené signálne molekuly môžu tiež riadiť typ zápalu tým, že prispievajú k diferenciácii alebo špecifikácii rôznych typov adaptívnych imunitných T buniek. Antigén je fagocytovaný a spracovaný bunkami vrodenej imunity, ktoré potom migrujú do najbližšej lymfatickej uzliny a prezentujú antigénny peptid natívnym T bunkám. V závislosti od typu antigénu, kostimulačných molekúl na vrodenej imunitnej bunke a kombinácií špecifických cytokínov dozrievajú natívne T bunky do špecifických podtypov, ktoré najlepšie slúžia zápalovému úsiliu odstrániť patogénny stimul. CD4 T bunky alebo T pomocné (Th) bunky možno rozdeliť do štyroch základných skupín, Th1, Th2, Th17 a T regulačné bunky (Treg). Th1 bunky sa podieľajú hlavne na regulácii imunitných odpovedí na intracelulárne mikroorganizmy a orgánovo špecifické autoimunitné ochorenia; Th2 sú kritické pre imunitu proti extracelulárnym patogénom, ako sú helminty, a sú zodpovedné za alergické zápalové ochorenia; Th17 bunky hrajú ústrednú úlohu pri ochrane proti mikrobiálnym výzvam, ako sú extracelulárne baktérie a huby; Treg bunky sa podieľajú na udržiavaní vlastnej tolerancie a regulácii imunitných reakcií. Zdá sa, že tento proces dozrievania T buniek je silne ovplyvnený senzorickými neurónovými mediátormi. Neuropeptidy, ako sú CGRP a VIP, môžu priviesť dendritické bunky k imunite typu Th2 a znížiť imunitu typu Th1 podporou produkcie určitých cytokínov a inhibíciou iných, ako aj znížením alebo zvýšením migrácie dendritických buniek do lokálnych lymfatických uzlín 8 , 10, 43. Senzorické neuróny tiež značne prispievajú k alergickému (hlavne Th2 riadenému) zápalu 17. Okrem regulácie Th1 a Th2 buniek môžu iné neuropeptidy, ako je SP a Hemokinín-1, poháňať zápalovú odpoveď viac smerom k Th17 alebo Treg 44, 45, čo znamená, že neuróny sa môžu tiež podieľať na regulácii zápalového riešenia. Pri imunopatologických stavoch, ako je kolitída a psoriáza, môže blokáda neuronálnych mediátorov, ako je látka P, významne tlmiť poškodenie T-buniek a imunitne sprostredkované15�17, hoci antagonizácia jedného mediátora môže mať sama osebe len obmedzený účinok na neurogénny zápal.
Vzhľadom na to, že signálne molekuly uvoľňované z periférnych senzorických nervových vlákien regulujú nielen malé krvné cievy, ale aj chemotaxiu, navádzanie, dozrievanie a aktiváciu imunitných buniek, začína byť jasné, že neuroimunitné interakcie sú oveľa zložitejšie, ako sa doteraz predpokladalo (obr. 2). Okrem toho je celkom možné, že to nie sú jednotlivé nervové mediátory, ale skôr špecifické kombinácie signálnych molekúl uvoľnených z nociceptorov, ktoré ovplyvňujú rôzne štádiá a typy imunitných reakcií.
Autonómna reflexná kontrola imunity
Zdá sa, že významná je aj úloha „reflexného okruhu“ cholinergného autonómneho nervového systému pri regulácii periférnych imunitných reakcií 46. Vagus je hlavný parasympatický nerv spájajúci mozgový kmeň s viscerálnymi orgánmi. Práca Kevina Traceyho a ďalších poukazuje na silné generalizované protizápalové reakcie pri septickom šoku a endotoxémii, ktoré sú spúšťané eferentnou aktivitou vagového nervu, ktorá vedie k potlačeniu periférnych makrofágov 47�49. Vagus aktivuje periférne adrenergné neuróny celiakálneho ganglia inervujúce slezinu, čo vedie k následnému uvoľňovaniu acetylcholínu, ktorý sa viaže na alfa-7 nikotínové receptory na makrofágoch v slezine a gastrointestinálnom trakte. To vyvoláva aktiváciu signálnej dráhy JAK2/STAT3 SOCS3, ktorá silne potláča transkripciu TNF-alfa 47. Adrenergný celiakálny ganglion tiež priamo komunikuje s podskupinou pamäťových T buniek produkujúcich acetylcholín, ktoré potláčajú zápalové makrofágy 48.
Invariantné prirodzené zabíjačské T bunky (iNKT) sú špecializovanou podskupinou T buniek, ktoré rozpoznávajú mikrobiálne lipidy v kontexte CD1d namiesto peptidových antigénov. NKT bunky sú kľúčovou populáciou lymfocytov zapojenou do boja proti infekčným patogénom a regulácie systémovej imunity. Bunky NKT sídlia a prechádzajú hlavne cez vaskulatúru a sínusoidy sleziny a pečene. Sympatické beta-adrenergné nervy v pečeni priamo signalizujú moduláciu aktivity NKT buniek 50. Napríklad počas myšacieho modelu mŕtvice (MCAO) bola mobilita NKT buniek pečene viditeľne potlačená, čo bolo zvrátené sympatickou denerváciou alebo beta-adrenergnými antagonistami. Okrem toho táto imunosupresívna aktivita noradrenergných neurónov na NKT bunkách viedla k zvýšeniu systémovej infekcie a poranenia pľúc. Preto eferentné signály z autonómnych neurónov môžu sprostredkovať silnú imunosupresiu.

Pohľad Dr. Alexa Jimeneza
Neurogénny zápal je lokálna zápalová reakcia generovaná nervovým systémom. Predpokladá sa, že hrá základnú úlohu v patogenéze rôznych zdravotných problémov, vrátane migrény, psoriázy, astmy, fibromyalgie, ekzému, rosacey, dystónie a mnohonásobnej chemickej citlivosti. Hoci bol neurogénny zápal spojený s periférnym nervovým systémom rozsiahlo skúmaný, koncept neurogénneho zápalu v centrálnom nervovom systéme ešte potrebuje ďalší výskum. Podľa niekoľkých výskumných štúdií sa však predpokladá, že nedostatok horčíka je hlavnou príčinou neurogénneho zápalu. Nasledujúci článok demonštruje prehľad mechanizmov neurogénneho zápalu v nervovom systéme, ktorý môže zdravotníckym pracovníkom pomôcť určiť najlepší liečebný prístup k starostlivosti o rôzne zdravotné problémy spojené s nervovým systémom.
Závery
Aké sú konkrétne úlohy somatosenzorického a autonómneho nervového systému pri regulácii zápalu a imunitného systému (obr. 4)? Aktivácia nociceptorov vedie k lokálnym axónovým reflexom, ktoré lokálne získavajú a aktivujú imunitné bunky, a preto sú hlavne prozápalové a priestorovo obmedzené. Na rozdiel od toho autonómna stimulácia vedie k systémovej imunosupresii ovplyvnením skupín imunitných buniek v pečeni a slezine. Mechanizmy aferentnej signalizácie na periférii vedúce k spusteniu imunosupresívneho vagového cholinergného reflexného okruhu nie sú dostatočne známe. Avšak 80 – 90 % vagových vlákien sú primárne aferentné senzorické vlákna, a preto signály z vnútorností, z ktorých mnohé sú potenciálne poháňané imunitnými bunkami, môžu viesť k aktivácii interneurónov v mozgovom kmeni a cez ne k výstupu v eferentných vagových vláknach 46.
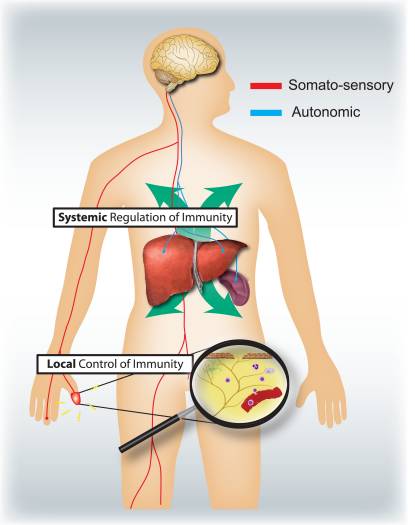
Obrázok 4: Senzorické a autonómne nervové systémy modulujú lokálne a systémové imunitné reakcie. Nociceptory inervujúce povrchy epitelu (napr. kožu a pľúca) indukujú lokalizované zápalové reakcie, aktivujú žírne a dendritické bunky. Pri alergickom zápale dýchacích ciest, dermatitíde a reumatoidnej artritíde zohrávajú nociceptorové neuróny úlohu pri riadení zápalu. Naproti tomu autonómne okruhy inervujúce viscerálne orgány (napr. slezinu a pečeň) regulujú systémové imunitné reakcie blokovaním aktivácie makrofágov a NKT buniek. Pri mŕtvici a septickej endotoxémii hrajú tieto neuróny imunosupresívnu úlohu.
Typicky je časový priebeh a povaha zápalu, či už počas infekcie, alergických reakcií alebo autoimunitných patológií, definovaná kategóriami zahrnutých imunitných buniek. Bude dôležité vedieť, aké rôzne typy imunitných buniek sú regulované senzorickými a autonómnymi signálmi. Systematické hodnotenie toho, aké mediátory sa môžu uvoľňovať z nociceptorov a autonómnych neurónov a expresia receptorov pre ne rôznymi vrodenými a adaptívnymi imunitnými bunkami, môže pomôcť vyriešiť túto otázku.
Počas evolúcie sa vyvinuli podobné molekulárne dráhy na detekciu nebezpečenstva pre vrodenú imunitu aj nocicepciu, aj keď bunky majú úplne odlišné vývojové línie. Zatiaľ čo PRR a škodlivé iónové kanály riadené ligandom študujú imunológovia a neurobiológovia oddelene, hranica medzi týmito dvoma oblasťami je čoraz nejasnejšia. Počas poškodenia tkaniva a patogénnej infekcie uvoľnenie nebezpečných signálov pravdepodobne povedie ku koordinovanej aktivácii periférnych neurónov a imunitných buniek s komplexnou obojsmernou komunikáciou a integrovanou obranou hostiteľa. Anatomické umiestnenie nociceptorov na rozhraní s prostredím, rýchlosť nervovej transdukcie a ich schopnosť uvoľňovať silné koktaily imunitne pôsobiacich mediátorov umožňuje periférnemu nervovému systému aktívne modulovať vrodenú imunitnú reakciu a koordinovať adaptívnu imunitu. Naopak, nociceptory sú vysoko citlivé na imunitné mediátory, ktoré aktivujú a senzibilizujú neuróny. Neurogénne a imunitne sprostredkované zápaly preto nie sú nezávislé jednotky, ale pôsobia spoločne ako zariadenia včasného varovania. Avšak periférny nervový systém tiež hrá dôležitú úlohu v patofyziológii, a možno etiológie, mnohých imunitných ochorení, ako je astma, psoriáza alebo kolitída, pretože jeho schopnosť aktivovať imunitný systém môže zosilniť patologický zápal 15�17. Preto môže byť potrebné, aby liečba imunitných porúch zahŕňala zacielenie nociceptorov, ako aj imunitných buniek.
Poďakovanie
Ďakujeme NIH za podporu (2R37NS039518).
Záverom možno povedať,Pochopenie úlohy neurogénneho zápalu, pokiaľ ide o obranu hostiteľa a imunopatológiu, je nevyhnutné na určenie správneho liečebného prístupu pre rôzne zdravotné problémy nervového systému. Pri pohľade na interakcie periférnych neurónov s imunitnými bunkami môžu zdravotnícki pracovníci pokročiť v terapeutických prístupoch, aby ďalej pomohli zvýšiť obranu hostiteľa, ako aj potlačiť imunopatológiu. Účelom vyššie uvedeného výrobku je pomôcť pacientom pochopiť klinickú neurophysiológiu neuropatie, okrem iných zdravotných problémov zranenia nervu. Informácie s odkazom na Národné centrum pre biotechnologické informácie (NCBI). Rozsah našich informácií je obmedzený na chiropraktiku, ako aj na poranenia a stavy chrbtice. Ak chcete prediskutovať túto tému, neváhajte sa opýtať Dr. Jimeneza alebo nás kontaktujte na adrese�915-850-0900 .
Kurátorom je Dr. Alex Jimenez
Ďalšie témy: Bolesť chrbta
Bolesti chrbta je jednou z najčastejších príčin invalidity a vymeškaných dní v práci na celom svete. Bolesti chrbta sa v skutočnosti pripisujú ako druhý najčastejší dôvod návštevy lekára, prevyšujú ju len infekcie horných dýchacích ciest. Približne 80 percent populácie aspoň raz za život zažije nejaký typ bolesti chrbta. Chrbtica je zložitá štruktúra pozostávajúca z kostí, kĺbov, väzov a svalov, okrem iného z mäkkých tkanív. Z tohto dôvodu môžu zranenia a/alebo zhoršené stavy, ako napr herné disky, môže nakoniec viesť k príznakom bolesti chrbta. Športové zranenia alebo zranenia pri automobilových nehodách sú často najčastejšou príčinou bolesti chrbta, niekedy však môžu mať aj tie najjednoduchšie pohyby bolestivé následky. Našťastie alternatívne možnosti liečby, ako je chiropraktická starostlivosť, môžu pomôcť zmierniť bolesť chrbta pomocou úprav chrbtice a manuálnych manipulácií, čo v konečnom dôsledku zlepšuje úľavu od bolesti.

EXTRA DÔLEŽITÁ TÉMA: Liečba bolesti krížov
ĎALŠIE TÉMY: EXTRA EXTRA:�Chronická bolesť a liečba
prázdny
Referencie
Zatvorte akordeón
Informácie tu uvedené o „Úloha neurogénneho zápalu" nie je určený na nahradenie vzťahu jeden na jedného s kvalifikovaným zdravotníckym pracovníkom alebo licencovaným lekárom a nie je to lekárska rada. Odporúčame vám, aby ste rozhodnutia v oblasti zdravotnej starostlivosti robili na základe vášho výskumu a partnerstva s kvalifikovaným zdravotníckym pracovníkom.
Informácie o blogu a diskusie o rozsahu
Náš informačný rozsah sa obmedzuje na chiropraktické, muskuloskeletálne, fyzické lieky, wellness, prispievajúce etiologické viscerozomatické poruchy v rámci klinických prezentácií, súvisiacej somatoviscerálnej reflexnej klinickej dynamiky, subluxačných komplexov, citlivých zdravotných problémov a/alebo článkov, tém a diskusií o funkčnej medicíne.
Poskytujeme a prezentujeme klinická spolupráca so špecialistami z rôznych odborov. Každý špecialista sa riadi svojím odborným rozsahom praxe a jurisdikciou udeľovania licencií. Funkčné zdravotné a wellness protokoly používame na liečbu a podporu starostlivosti o zranenia alebo poruchy pohybového aparátu.
Naše videá, príspevky, témy, predmety a postrehy pokrývajú klinické záležitosti, problémy a témy, ktoré sa týkajú a priamo či nepriamo podporujú náš klinický rozsah praxe.*
Naša kancelária sa primerane pokúsila poskytnúť podporné citácie a identifikovala relevantnú výskumnú štúdiu alebo štúdie podporujúce naše príspevky. Na požiadanie poskytujeme kópie podporných výskumných štúdií, ktoré majú regulačné rady a verejnosť k dispozícii.
Rozumieme, že pokrývame záležitosti, ktoré si vyžadujú ďalšie vysvetlenie, ako môže pomôcť v konkrétnom pláne starostlivosti alebo v protokole liečby; na ďalšiu diskusiu o vyššie uvedenej téme sa preto môžete pokojne opýtať Dr. Alex Jimenez, DC, Alebo kontaktujte nás na adrese 915-850-0900.
Sme tu, aby sme vám a vašej rodine pomohli.
Požehnanie
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencovaný ako doktor chiropraxe (DC) v Texas & Nové Mexiko*
Číslo licencie Texas DC TX5807, New Mexico DC Licencia č. NM-DC2182
Licencovaná ako registrovaná zdravotná sestra (RN*) in Florida
Floridská licencia RN licencia # RN9617241 (Kontrola č. 3558029)
Kompaktný stav: Viacštátna licencia: Oprávnený vykonávať prax v Štáty 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitálna vizitka